
一定温度下,在2 L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:K300 ℃>K350 ℃,且n(NO2)(单位:mol)随时间变化如下表:
2N2O5(g);已知该反应的平衡常数:K300 ℃>K350 ℃,且n(NO2)(单位:mol)随时间变化如下表:
时间(s) | 0 | 500 | 1000 | 1500 |
t1℃ | 20 | 13.96 | 10.08 | 10.08 |
t2℃ | 20 | a | b | c |
下列说法一定正确的是( )
A.正反应为吸热反应
B.如果t2℃<t1℃,那么a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1 000 s至1 500 s之间
D.如果t2℃>t1℃,那么b>10.08
科目:高中化学 来源:2014年高考化学 题型十一 图像分析型专题练习卷(解析版) 题型:选择题
关于下列各图的叙述,正确的是( )
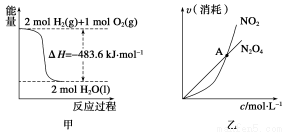
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
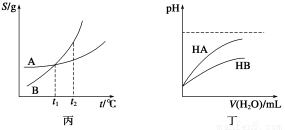
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1 ℃升温至t2 ℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型五 物质结构型专题练习卷(解析版) 题型:选择题
根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
元素代号ABCDE
原子半径/nm0.1860.1430.0890.1020.074
主要化合价+1+3+2+6、-2-2
A.最高价氧化物对应水化物的碱性A>C
B.氢化物的沸点H2D>H2E
C.单质与稀盐酸反应的速率A<B
D.C2+与A+的核外电子数相等
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型二 化学用语型专题练习卷(解析版) 题型:选择题
下列化学用语表达正确的是( )
A.对硝基甲苯的结构简式: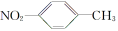
B.CH2F2的电子式: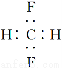
C.16O2与18O2互为同素异形体
D.乙炔的最简式:CH
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型九 速率平衡型专题练习卷(解析版) 题型:选择题
密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示。下列说法正确的是( )
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示。下列说法正确的是( )
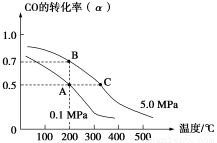
A.若A、B两点表示在某时刻达到的平衡状态,此时A、B两点时容器中,n(A)总∶n(B)总=4∶5
B.若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA<tC
C.设B、C两点的平衡常数分别为KB、KC,则KB<KC
D.在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型三 NA应用型专题练习卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.25 ℃时,pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
B.室温下,14.0 g乙烯和丁烯的混合气体中含有C—H键数目为2.0NA
C.1 L 0.5 mol·L-1的(NH4)2SO4溶液中含有的NH4+数目为NA
D.标准状况下,22.4 L CCl4中含有共用电子对数目为4.0NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型七 网络构建型专题练习卷(解析版) 题型:选择题
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是( )
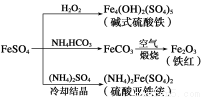
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型一 化学社会型专题练习卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关。下列说法中不正确的是( )
A.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致
B.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
C.绿色化学的核心是从源头上消除工业生产对环境的污染
D.用CO2合成聚碳酸酯可降解塑料,可实现“碳”的循环利用
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3章物质聚集状态物质性质练习卷(解析版) 题型:选择题
已知A元素原子核外电子共占有5个轨道且有2个成单电子;B元素原子核外能量最高电子为:n=3、l=1、m=1、ms=+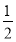 ,n=3、l=1、m=0、ms=+
,n=3、l=1、m=0、ms=+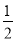 。则A、B两元素所形成化合物的晶体类型为( )。
。则A、B两元素所形成化合物的晶体类型为( )。
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com