
| A、FeCl3 |
| B、HNO3 |
| C、HCl |
| D、KNO3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,10mlpH=12的氢氧化钠溶液中加入10mlpH=2的HA,所得溶液pH≤7 |
| B、25℃时,0.1mol/L与0.01mol/L的氯化铵溶液的pH前者大 |
| C、室温时浓度均为0.1mol/L的NH3?H2O和NH4Cl的混合液,pH为10,则,c(NH4+)+c(H+)<c(NH3?H2O)+c(OH-) |
| D、0.1mol/LNa2S溶液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
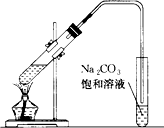 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①④ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
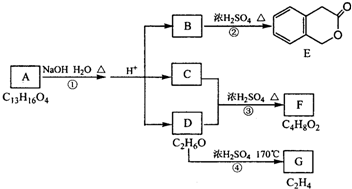
查看答案和解析>>
科目:高中化学 来源: 题型:
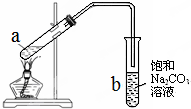 如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )| A、向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 |
| B、实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 |
| C、试管b中Na2CO3的作用是除去随乙酸乙酯蒸出的少量乙酸和乙醇,降低乙酸乙酯在溶液中溶解度 |
| D、试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.1 g镁铝合金中含有镁、铝的质量分别为2.4 g、2.7 g |
| B、溶解5.1 g镁铝合金时,剩余盐酸的物质的量为0.1 mol |
| C、生成白色沉淀的最大质量为13.6 g |
| D、若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com