
少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体
③滴入几滴浓盐酸 ④加CH3COONa固体
⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸.
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑤⑦⑧
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上9月月考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X > Z > W
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 这四种元素的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期9月调研化学试卷(解析版) 题型:选择题
根据碘与氢气反应的热化学方程式
(i)I2(g)+H2(g) 2HI(g) △H= - 9.48kJ/mol
2HI(g) △H= - 9.48kJ/mol
(ii) I2(s)+H2(g) 2HI(g) △H= + 26.48kJ/mol,下列判断正确的是 ( )
2HI(g) △H= + 26.48kJ/mol,下列判断正确的是 ( )
A.254gI2(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差l7.00kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(i)拆开1molI-I键与1molH-H键需要的总能量小于拆开2molH-I键需要的总能量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期初考试化学卷(解析版) 题型:填空题
向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段使用了催化剂;图一中t0~t1阶段c(B)未画出.

(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=______________.
(2)t4~t5阶段改变的条件为______________,B的起始物质的量为______________.
(3)判断图一中可逆反应达到平衡状态的依据是(填序号)______________.
①2v正(A)=3v逆(C)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④A、B、C的浓度都不再发生变化
(4)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:______________.
(5)容器乙与容器甲的体积相同且保持不变,且乙容器的温度恒定为甲容器t4~t5时的温度,若要使C的平衡浓度为1.2mol/L,则在乙容器中加入1.2molA、0.6molB的同时还需要加入___________molC。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期初考试化学卷(解析版) 题型:选择题
盖斯定律在生产和科学研究中有很重要的意义。已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,放出了X kJ热量。已知碳完全燃烧的焓变△H= 一Y kJ·mol-1,则lmol C与O2反应生成CO的反应热△H为 ( ) kJ·mol-1
A.一Y B.—(10X—Y) C.一(5X—O.5Y) D.+(10X—Y)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期初考试化学卷(解析版) 题型:选择题
已知反应:2CrO42-(黄)+2H+ =Cr2O72-(橙)+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,下列有关叙述正确的是( )

A.CrO42-生成Cr2O72-的反应为非氧化还原反应,不能通过电解方法获得
B.电源左侧是正极
C.右侧电极的电极反应为:2H2O+2e-=H2+2OH-
D.Na+从右侧通过膜进入左侧
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:填空题
在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g) 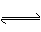 CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________,该反应为__________反应(填吸热或放热)。若改变条件使平衡向正反应方向移动,则平衡常数_____________(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是___________。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3) 将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应CO (g) + H2O (g) CO2 (g) + H2 (g),得到如下三组数
CO2 (g) + H2 (g),得到如下三组数 据:
据:
实验组 | 温度/℃ | 起始 | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 900 | a | b | c | d | t |
①实验A中以υ(H2) 表示的反应速率为 。
②通过计算可知,CO的转化率实验A 实验B(填“大于”、“等于”或“小于”),该反应的正反应为 (填“吸”或“放”)热反应。
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是 (用含a、b的数学式表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:选择题
已知“凡气体分子总数增多的反应一定是熵增大的反应”。根据所学知识判断,下列反应中,在所有温度下都不自发进行的是( )
A.2O3(g)===3O2(g)△H<0
B.2CO(g)===2C(s)+O2(g)△H>0
C.N2(g)+3H2(g)===2NH3(g)△H<0
D.CaCO3(s)===CaO(s)+CO2(g)△H>0
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上入学考试化学试卷(解析版) 题型:选择题
羟胺( )是一种还原剂.现用
)是一种还原剂.现用 的羟胺的酸性溶液跟足量的
的羟胺的酸性溶液跟足量的 溶液在煮沸条件下反应,生成
溶液在煮沸条件下反应,生成 离子恰好与
离子恰好与
 的酸性
的酸性 溶液完全作用生成
溶液完全作用生成 ,
, 等物质,则上述反应中羟胺的氧化产物是
等物质,则上述反应中羟胺的氧化产物是
A. B.
B. C.NO D.
C.NO D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com