
【题目】下列关于N2的叙述错误的是( )
A.N2既可作氧化剂又可做还原剂
B.雷雨天,空气中的N2和O2可反应生成NO
C.氮的固定是将N2转化成含氮化合物
D.NO和NO2都可稳定存在于空气中
科目:高中化学 来源: 题型:
【题目】主链为4个碳原子的单烯烃共有4种同分异构体,则与这种单烯烃具有相同的碳原子数、主链也为4个碳原子的某烷烃有( )。
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸滴定10.00 mL0.1mol/L的碱MOH,滴定过程中加入醋酸的体积(V) 与溶液中lg[C(H+)/c(OH-)]的关系如图所示。下列说法正确的是

A. MOH的电离方程式为MOH![]() M++OH-
M++OH-
B. a 点:V(CH3COOH)= 10.00mL
C. b点:c(CH3COO-)>c(H+ )>c(M+)>c(OH-)
D. 25℃,时,CH3COO-的水解平衡常数为(10/17)×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.5 g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶于水,制成稀溶液,然后向该溶液中逐滴加入1 mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:(提示:碳酸钠与少量盐酸反应生成碳酸氢钠和氯化钠。)

(1)写出OA段所发生反应的化学方程式___________________________。
(2)当加入35 mL盐酸时,产生CO2的体积为________mL(标准状况)。
(3)原混合物中NaOH的质量为________g,碳酸钠的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。

回答下列问题:
(1)甲烷燃料电池负极的电极反应式为________________________。
(2)闭合开关K后,a、b电极上均有气体产生,其中b电极上得到的是________,电解氯化钠溶液的总反应方程式为__________________________。
II.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)

(1)图中a极要连接电源的(填“正”或“负”)________极,C口流出的物质是________。
(2)b电极SO![]() 放电的电极反应式为____________。
放电的电极反应式为____________。
(3)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向足量的饱和Na2CO3溶液中加入1.06g无水Na2CO3,充分搅拌后静置,最终所得晶体(Na2CO310H2O)的质量 ( )
A. 等于1.06g B. 大于1.06g而小于2.86g C. 等于2.86g D. 大于2.86g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25C时,氯水中部分含氯的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的百分數) 与pH的关系如下图所示。

下列叙述正确的是
A. 新制的pH=1的氯水中,c(C13-)>c(HClO)>c(H+)
B. 新制氯水中持续通入SO2,pH不断变小,溶液颜色不断加深
C. 25℃时,HClO![]() H++ClO-的电离常数Ka的对数值为lgKa=-7.54
H++ClO-的电离常数Ka的对数值为lgKa=-7.54
D. pH=6的氯水中加入NaOH溶液,主要发生的离子反应方程式为HClO+OH-=ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种易挥发的液体,它是一种重要的化工原料,也是一种清洁能源。
(1)已知:①CO(g) + 2H2(g) ![]() CH3OH(l) ΔH=-128.1 kJ·mol-1
CH3OH(l) ΔH=-128.1 kJ·mol-1
②2H2(g) + O2(g) = 2H2O(l) ΔH=-571.6 kJ·mol-1
③H2(g) + 1/2O2(g) = H2O(g) ΔH=-241.8 kJ·mol-1
④2CO(g) + O2(g) = 2CO2(g) ΔH=-566.0 kJ·mol-1
写出表示CH3OH燃烧热的热化学方程式:________________________________。
(2)不同温度下,将1.0 molCH4和2.4molH2O(g)通入容积为10 L的恒容密闭容器中发生如下反应: CH4(g)+ H2O(g) ![]() CO(g) + 3H2(g),测得体系中H2O的体积百分含量随着时间的变化情况如下图所示:
CO(g) + 3H2(g),测得体系中H2O的体积百分含量随着时间的变化情况如下图所示:
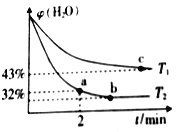
①T1____T2(填“>”“<”或“=”,下同),其对应的平衡常数K1____K2。
②温度T2下,从反应开始到2min时,ν(H2O)=___________。
③T1温度时,若已知到达平衡是H2O(g)的体积百分含量为40%,则该温度下上述反应的平衡常数K=____________。(保留两位小数点)
(3)科学家用氮化镓组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成了CH4。铜电极表面的电极反应式为__________________________。

(4)已知CO可与I2O5反应:5 CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)。将甲醇不完全燃烧产生的500mL(标准状况)气体用足量的I2O5处理后,将所得的I2准确地配成100mL碘的酒精溶液。再取25.00mL该溶液加入淀粉溶液作指示剂后用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL(气体样品中其它成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)。
5CO2(g)+I2(s)。将甲醇不完全燃烧产生的500mL(标准状况)气体用足量的I2O5处理后,将所得的I2准确地配成100mL碘的酒精溶液。再取25.00mL该溶液加入淀粉溶液作指示剂后用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL(气体样品中其它成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)。
①滴定终点时溶液颜色变化为____________________________。
②气体样品中CO的体积分数为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com