
【题目】水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
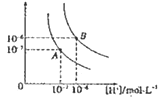
A. 纯水中25℃时的c(H+)比100℃时的c(H+)大
B. 25℃时某溶液中由水电离产生的c( H+)> =1×10-ll molL-1,则该溶液的pH可能是11或3
C. 将pH = 9的Ba(OH)2溶液与pH =4的稀盐酸混合,并保持100 ℃的恒温,混合溶液的PH=7,则此Ba(OH)2的溶液和盐酸的体积比为10:1
D. 100℃时,某 NaS04 溶液中 c(S042- ) =5 ×10 -4mol L-1,则溶液中 c(Na+): c(OH-)为104:1
【答案】B
【解析】A、水的电离为吸热反应,升高温度,水的电离程度增大,氢离子浓度增大,所以纯水中25°C时的c(H+)比100℃的时c(H+)小,A错误;B、根据题给图像知,250℃时水的离子积为10-14,由水电离产生的c(H+)=1×10-11molL-1,若溶液为酸性溶液,氢离子浓度为:0.001mol/L,溶液的pH=3;若溶液为碱性溶液,则溶液中氢离子浓度为1×10-11molL-1,溶液pH=11,B正确;C、100℃时水的离子积为10-12,混合溶液的pH=7,反应后的溶液为碱性溶液,溶液中氢离子浓度为1×10-7molL-1,氢氧根离子浓度为1×10-5molL-1;pH=9的Ba(OH)2溶液中氢氧根离子浓度为1×10-3molL-1,与pH=4的稀盐中氢离子浓度为1×10-4molL-1,设氢氧化钡的体积为x,盐酸溶液的晶体为y,则:(103x104y)/(x+y) =1×10-5,解得x:y=1:10,C错误;D、100℃时,中性溶液中氢氧根离子浓度为1.0×10-6mol/L,c(S042- )=5×10-4molL-1,则硫酸钠溶液中钠离子浓度为1.0×10-3mol/L,溶液中c(Na+):c(OH-)=1.0×10-3mol/L:1.0×10-6mol/L=103:1,D错误,答案选B。


科目:高中化学 来源: 题型:
【题目】碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)碳酸钠俗称________,可作为碱使用的原因是___________(用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g)= Na2CO3(s)+H2O(g) ΔH1=127.4 kJ·mol1
②NaOH(s)+CO2(g)= NaHCO3(s) ΔH1=131.5 kJ·mol1
反应2NaHCO3(s)= Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=_______ kJ·mol1,该反应的平衡常数表达式K=________。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中![]() =_____________。已知Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010。
=_____________。已知Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 煤的干馏、煤的气化和液化都是化学变化,石油的分馏是物理变化
B. 葡萄糖与果糖、淀粉与纤维素分子式相同结构不同,均互为同分异构体
C. 只有一种元素组成的物质一定是纯净物
D. 单质硅可用于制造硅太阳能电池以及光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
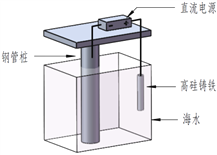
A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A元素的一种同位素,比镤91—239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
A.第3周期第ⅠA族B.第4周期第ⅠA族
C.第5周期第ⅠA族D.第3周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在密闭容器中进行的可逆反应2SO2(g)+18O2(g)2SO3(g),下列说法正确的是( )
A. 容器内只含有18O2、SO2、SO3三种分子
B. 18O只存在18O2分子中
C. 容器内含有18O2、S18O2、S18O3等分子
D. 反应达到限度时,所有物质的质量都相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com