
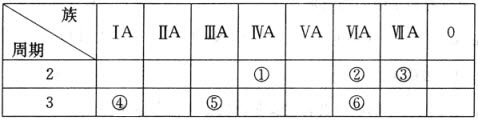
分析 由元素在周期表中的位置可知,①为C、②为O、③为F、④为Na、⑤为Al、⑥为S,
(1)同周期自左而右元素非金属性增强;
(2)⑥为S元素,最低负化合价为-2,据此书写氢化物化学式;
(3)④、⑤两种元素的最高价氧化物对应的水化物分别为氢氧化铝、NaOH,二者反应生成偏铝酸钠与水.
解答 解:由元素在周期表中的位置可知,①为C、②为O、③为F、④为Na、⑤为Al、⑥为S,
(1)①、②、③同周期,原子序数依次增大,自左而右元素非金属性增强,故F元素非金属性最强,故答案为:F;
(2)⑥为S元素,最低负化合价为-2,其氢化物化学式为H2S,故答案为:H2S;
(3)④、⑤两种元素的最高价氧化物对应的水化物分别为氢氧化铝、NaOH,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查了元素周期表和元素周期律的综合应用,根据元素在周期表中的位置确定元素,再结合元素周期律来分析解答,熟练掌握元素周期律内涵及外延,灵活运用元素周期律解答问题,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
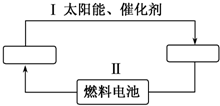 氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的氯化铵溶液,用蒸馏水稀释10倍后,溶液的pH=5 | |
| B. | pH=3的盐酸与pH=3的CH3COOH溶液相比,c(Cl-)>C(CH3COO-) | |
| C. | pH=2的一元酸HA溶液与pH=12的NaOH溶液以体积比1:1混合后,c(Na+)≤c(A-) | |
| D. | pH相同的NaOH、NaClO两种溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是表示化学反应快慢的物理量 | |
| B. | 一般情况下,升高温度能加快化学反应速率 | |
| C. | 可逆反应达到化学反应限度时,反应就静止不动了 | |
| D. | 可逆反应达到化学反应限度时,正反应速率等于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通过Na2O2使其增重a g时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ | |
| B. | 将1mol Cl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| C. | 常温常压下,3.0 g 含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA | |
| D. | 2.24L的CH4中含有的C-H键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A、NaOH | B、Na2SO4 | C、NH4Cl | |
| c(H+) | 减小 | ① | 增 大 |
| c(OH-) | ② | 不 变 | ③ |
| c(H+)与c(OH-)的大小比较 | ④ | = | > |
| 溶液的酸碱性 | 碱 性 | ⑤ | 酸 性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
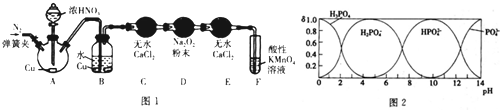
| 化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×108 | 4.9×10-10 | K1=4.3×10-7 K1=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com