
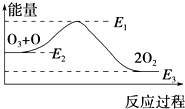
 氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.
氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.| A. | 反应O3+O═2O2的△H=E1-E3 | B. | 反应O3+O═2O2是吸热反应 | ||
| C. | △H=△H1+△H2 | D. | 氯原子没有改变O3分解反应的历程 |
分析 由图可知,O+O3=2O2 的反应为放热反应,△H=E3-E2,由Cl+O3=ClO+O2 △H1、ClO+O=Cl+O2 △H2可知,利用盖斯定律来分析反应热的关系,氯原子在该反应中作催化催,改变了该反应的活化能,以此来解答.
解答 解:A.由图可知,生成物的能量低,O+O3=2O2 的反应为放热反应,△H=E3-E2,故A错误;
B.O+O3=2O2 的反应中△H=E3-E2 <0,为放热反应,故B错误;
C.由Cl+O3=ClO+O2 △H1、ClO+O=Cl+O2 △H2可知,根据盖斯定律两个反应相加得到O+O3=2O2 ,即△H=△H1+△H2,故C正确;
D.氯原子在该反应中作催化催,改变了该反应的活化能,即改变了O3分解反应的历程,故D错误;
故选C.
点评 本题考查化学反应中的能量变化及盖斯定律,催化剂对反应的作用,明确信息及图象的分析是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
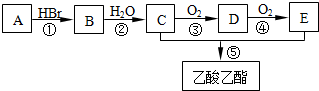
 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.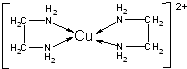
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
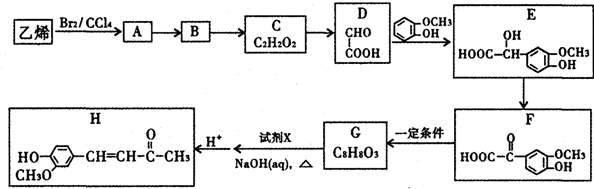
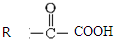 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ 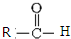 +CO2
+CO2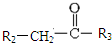 $\stackrel{NaOH(aq),△}{→}$
$\stackrel{NaOH(aq),△}{→}$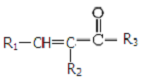 +H2O
+H2O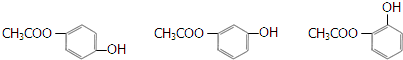 (其中之一).
(其中之一).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
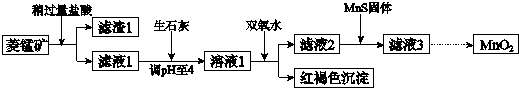
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子晶体的熔点一定比分子晶体高 | |
| B. | SO2和SO3均是非极性分子 | |
| C. | PCl3分子中P-Cl的键角小于109°28? | |
| D. | 晶体中有阳离子必有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
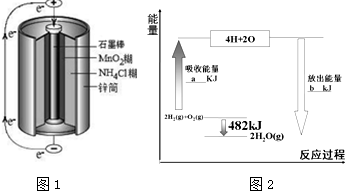 按要求回答下列各题:
按要求回答下列各题:
 ;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)| 共价键 | H-H | O=O | H-O |
| 键能/kJ•mol-1 | 436 | 498 | X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com