

| A. | ①液体分层,下层呈无色 | |
| B. | ②洗涤沉淀时,向漏斗中加适量水,搅拌并滤干 | |
| C. | ③分离CCl4和水 | |
| D. | ④除去氯气中的氯化氢 |
分析 A.四氯化碳的密度比水的密度大,分层后有机层在下层;
B.过滤时不能搅拌;
C.CCl4和水分层,水的密度小在上层;
D.除杂时导管应长进短出.
解答 解:A.四氯化碳的密度比水的密度大,分层后有机层在下层,则上层为无色,有机色层在下层,故A错误;
B.过滤时不能搅拌,易将滤纸捣破,故B错误;
C.CCl4和水分层,水的密度小在上层,则利用图中分液装置可分离,故C正确;
D.除杂时导管应长进短出,图中气体的进入方向不合理,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、分离方法是解答本题的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 对于某一反应来说,化学反应速率始终相同 | |
| B. | 化学反应速率越大,说明单位时间内物质的量变化越大 | |
| C. | 对于可逆反应,达到平衡时正逆反应速率相等且等于零 | |
| D. | 改变适当的条件,可使化学平衡向需要的方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解得到的汽油是纯净物 | B. | 煤就是碳,属于单质 | ||
| C. | 煤的气化是物理变化过程 | D. | 天然气是一种清洁的化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CSO的电子式: | |
| B. | 甲烷分子的球棍模型: | |
| C. | 2-戊烯的结构简式CH3CH2CHCHCH3 | |
| D. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
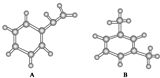
| A. | 两者都能使酸性KMnO4溶液褪色 | B. | 两者都能与溴水反应而使溴水褪色 | ||
| C. | 两者分子中所有原子均可能共平面 | D. | 两者的一氯代物的数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com