
| A. | 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2 | |
| B. | 等质量的O2与O3中,氧原子的个数比为3:2 | |
| C. | CaCl2及CaO2固体中阴、阳离子数之比均为2:1 | |
| D. | 10mL 0.3mol/LNaCl与30mL0.1mol/LAlCl3溶液中Cl-物质的量浓度比为1:3 |
分析 A.H2O2中O元素的化合价由-1价升高为0,KMnO4中O元素的化合价由-2价升高为0;
B.等质量的O2与O3中,O原子的质量相同;
C.CaCl2及CaO2固体中,阳离子均为钙离子,但阴离子分别为氯离子、过氧根离子;
D.0.3mol/LNaCl与0.1mol/LAlCl3溶液中Cl-物质的量浓度均为0.3mol/L.
解答 解:A.H2O2中O元素的化合价由-1价升高为0,KMnO4中O元素的化合价由-2价升高为0,由电子守恒可知,制得等质量O2时,转移电子数之比为1:2,故A正确;
B.等质量的O2与O3中,O原子的质量相同,则氧原子的个数比为1:1,故B错误;
C.CaCl2及CaO2固体中,阳离子均为钙离子,但阴离子分别为氯离子、过氧根离子,则阴、阳离子数之比分别为2:1、1:1,故C错误;
D.0.3mol/LNaCl与0.1mol/LAlCl3溶液中Cl-物质的量浓度均为0.3mol/L,则Cl-物质的量浓度比为1:1,故D错误;
故选A.
点评 本题考查氧化还原反应及有关计算,为高频考点,把握物质的构成、元素的化合价变化及物质的量计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
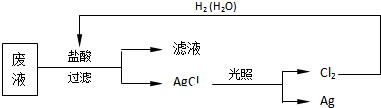
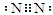 .
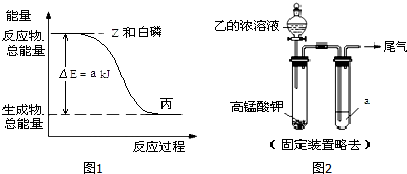
.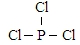 .白磷固体和 Z 气体反应,生成 1mol 液态丙时,能量变化如图1所示,写出该反应的热化学方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固体和 Z 气体反应,生成固态丁时,放热 bkJ,则 1mol 固态丁转化为液态丙时的反应热△H=(a-$\frac{b}{4}$ )kJ/mol.
.白磷固体和 Z 气体反应,生成 1mol 液态丙时,能量变化如图1所示,写出该反应的热化学方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固体和 Z 气体反应,生成固态丁时,放热 bkJ,则 1mol 固态丁转化为液态丙时的反应热△H=(a-$\frac{b}{4}$ )kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:4 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
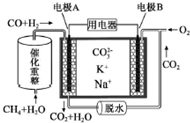
| A. | 反应CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1molCH4转移6mol 电子 | |
| B. | 电极A上CO参与的电极反应为:CO+CO32--2e-═2CO2↑ | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油是纯净物,乙醇汽油是混合物 | |
| B. | 苯、乙烯、乙酸和乙酸乙酯都能发生加成反应 | |
| C. | 石油的分馏和煤的干馏都发生了化学变化 | |
| D. | 除去乙酸乙酯中少量的乙酸,用饱和碳酸钠溶液洗涤后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com