
 $\stackrel{铑催化剂}{→}$
$\stackrel{铑催化剂}{→}$ (R1代表氢原子或烃基)
(R1代表氢原子或烃基)
 +
+ $\stackrel{碱}{→}$
$\stackrel{碱}{→}$ +H2O
+H2O .
.分析 由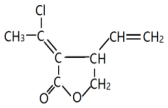 、结合张-烯炔环异构化反应,可知K为CH3C≡CCOOCH2CH=CHCH2Cl,而D与J发生酯化反应得到K,结合D的分子式可推知D为ClCH2CH=CHCH2OH、J为CH3C≡CCOOH.A发生信息中的反应得到B,B中含有碳碳双键与醛基,对比C、D分子式,可知C与氢气发生加成反应生成D,则C为ClCH2CH=CHCHO,B与氯气发生甲基中取代反应生成C,故B为CH3CH=CHCHO,则A为CH3CHO.B到J的转化中醛基转化为羧基、碳碳双键转化为碳碳三键,(6)中试剂b为氯气,结合G→H转化条件,可知应是发生消去反应,引入碳碳三键,则B→E→F转化引入-COOH,试剂a为新制氢氧化铜或银氨溶液,E为羧酸盐,F为CH3CH=CHCOOH,G为CH3CHClCHClCOOH,H为CH3C≡CCOONa.
、结合张-烯炔环异构化反应,可知K为CH3C≡CCOOCH2CH=CHCH2Cl,而D与J发生酯化反应得到K,结合D的分子式可推知D为ClCH2CH=CHCH2OH、J为CH3C≡CCOOH.A发生信息中的反应得到B,B中含有碳碳双键与醛基,对比C、D分子式,可知C与氢气发生加成反应生成D,则C为ClCH2CH=CHCHO,B与氯气发生甲基中取代反应生成C,故B为CH3CH=CHCHO,则A为CH3CHO.B到J的转化中醛基转化为羧基、碳碳双键转化为碳碳三键,(6)中试剂b为氯气,结合G→H转化条件,可知应是发生消去反应,引入碳碳三键,则B→E→F转化引入-COOH,试剂a为新制氢氧化铜或银氨溶液,E为羧酸盐,F为CH3CH=CHCOOH,G为CH3CHClCHClCOOH,H为CH3C≡CCOONa.
解答 解:(1)A为CH3CHO,官能团名称为醛基,B→C是CH3CH=CHCHO与氯气发生取代反应生成ClCH2CH=CHCHO,
故答案为:醛基;取代反应;
(2)A→B的化学反应方程式为:2CH3CHO$\stackrel{碱}{→}$CH3CH=CHCHO+H2O,
故答案为:2CH3CHO$\stackrel{碱}{→}$CH3CH=CHCHO+H2O;
(3)由上述分析可知,D的结构简式为ClCH2CH=CHCH2OH,
故答案为:ClCH2CH=CHCH2OH;
(4)①B为CH3CH=CHCHO,含有碳碳双键,能与Br2的四氯化碳溶液发生加成反应,碳碳双键、醛基均可以被酸性KMnO4氧化,溶液颜色均退去,故正确;
②转化中醛基氧化为羧基,试剂a是:银氨溶液或新制氢氧化铜悬浊液,故错误;
③J为CH3C≡CCOOH、A为CH3CHO,二者的核磁共振氢谱峰面积之比均为3:1,故正确.
故选:①③;
(5)与F(CH3CH=CHCOOH)具有相同官能团的同分异构体(不含顺反异构)的结构简式有:CH2=CHCH2COOH、CH2=C(CH3)COOH,
故答案为:CH2=CHCH2COOH、CH2=C(CH3)COOH;
(6)G→H反应的化学方程式是: ,
,
故答案为: ;
;
(7)D与J反应形成K的化学方程式是:ClCH2CH=CHCH2OH+CH3C≡CCOOH$→_{△}^{浓硫酸}$CH3C≡CCOOCH2CH=CHCH2Cl+H2O,
故答案为:ClCH2CH=CHCH2OH+CH3C≡CCOOH$→_{△}^{浓硫酸}$CH3C≡CCOOCH2CH=CHCH2Cl+H2O.
点评 本题考查有机物的推断与合成,结合目标物的结构简式采取正逆推法进行推断,需要学生熟练掌握官能团的性质与转化,较好的考查学生自学能力、分析推理能力,关键是理解“张-烯炔环异构化反应”.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.
利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 2:3 | C. | 3:5 | D. | 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C6H14O的醚有15种 | |
| B. | 将气体通过酸性高锰酸钾溶液可提纯含有乙烯杂质的乙烷 | |
| C. | 分馏、干馏都属于物理变化,裂化、裂解都属于化学变化 | |
| D. | 聚乙烯、橡胶、聚酯纤维都是通过加聚反应制得的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+b+2a+2 X | B. | a+b-2a-2 X | C. | b-2a+2 X | D. | ba X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com