
【题目】表示氢气燃烧热的是( )
A. H2(g)+![]() O2(g)=H2O(g)△H=﹣241.8 kJ/mol
O2(g)=H2O(g)△H=﹣241.8 kJ/mol
B. 2H2(g)+O2(g)=2H2O(g)△H=﹣483.6 kJ/mol
C. H2(g)+![]() O2(g)=H2O(l)△H=﹣285.8 kJ/mol
O2(g)=H2O(l)△H=﹣285.8 kJ/mol
D. 2H2(g)+O2(g)=2H2O(l)△H=﹣571.6 kJ/mol
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是
图1 图2
图2
A. 选择合适的试剂,用图1所示装置可制取和收集少量CO2、NO和O2
B. 实验室制备氢氧化铝时,可向硫酸铝溶液中逐滴加入稀氨水
C. 可用图 2装置分离碘和四氯化碳溶液
D. 配制100mL 0.1 mol/L NaCl溶液时,用托盘天平准确称取NaCl固体5.85g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):下列说法不正确的是
![]()
A. 若W是单质铁,则Z溶液可能是FeCl2溶液
B. 若W是氢氧化钠,则X水溶液呈酸性
C. 若W是氧气,则X、Z的相对分子质量可能相差48
D. 若W是强氧化性的单质,则X可能是金属铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α-氰基烯酸酯类医用胶无毒无害、性质稳定、与生物组织粘合好,可用做手术伤口粘合剂。其分子结构可用如图所示的通式表示:

资料卡片:
①分子中 “—R1”部分碳链适当增长,有助于延长固化时间。
②分子中 “-R2”部分碳链增长,耐水性增强,更适合在水湿环境中粘合。
③分子中 “-R2”部分若再引入一个α-氰基烯酸酯的结构,则可发生交联聚合,使胶膜硬度、韧性均增强。
(1)502胶是应用最早的医用胶,主要成分是![]() 。
。
① 该分子中含有的官能团是氰基(—CN)、碳碳双键和_______。
② 该物质具有粘合性的原因是发生加聚反应(微量水蒸气作用下),化学方程式是_______。
③ 常温下,丙烯难以聚合,而502胶可以快速聚合。从分子结构的角度分析产生该差异的原因是_______。
(2)科学家已将502胶改良为504胶(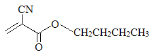 ),504胶相对502胶的优点是_______。
),504胶相对502胶的优点是_______。
(3)用于粘接骨骼的“接骨胶”固化时间不能太短,且粘合后强度要高。请设计一种 “接骨胶”,写出其主要成分的结构简式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】EPR橡胶(聚乙丙烯)和工程材料聚碳酸酯(简称PC)的一种合成路线如下:

已知:酯与含羟基的化合物可发生如下酯交换反应:RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
请回答:
(1)D中所含的官能团是_______。
(2)EPR橡胶的结构简式_______。
(3)下列说法正确的是_______(填字母)。
a.反应③的原子利用率为100%
b.反应④为取代反应
c.1mol F与足量金属Na反应,最多可生成22.4L H2(标准状况下)
(4)反应②的化学方程式是_______。
(5)反应②生成E时会产生多种副产物,其中有一种分子式为C9H12O2的副产物M,其结构简式为_______。
(6)反应⑤的化学方程式是_______。
(7)已知: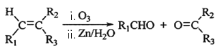 (R1、R2、R3代表烃基)写出以D为原料合成己二酸[HOOC(CH2)4COOH]的合成路线,无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件_______________________。
(R1、R2、R3代表烃基)写出以D为原料合成己二酸[HOOC(CH2)4COOH]的合成路线,无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件_______________________。
示例:CH3CH2OH![]() CH2=CH2
CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量的蔗糖(C12H22O11)放入烧杯中,滴入几滴水并搅拌均匀,然后再加入适量的浓硫酸,迅速搅拌,放出大量的热,同时观察到固体逐渐变黑。片刻后,黑色物质急剧膨胀,并产生大量刺激性气味的气体(实验过程如图所示)
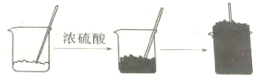
(1)固体变黑体现了浓硫酸的__________性。
(2)为了确定刺激性气味气体的成分,收集性所得气体,分别进行如下实验。
①将气体通入品红溶液后,溶液褪色,加热,颜色恢复。说明该气体中一定含有_________。
②将气体通入澄清石灰水,溶液变浑浊,_________(填“能”或“不能”)证明气体中含有CO2,其理由为______(用离子方程式表示)。
③刺激性气味气体产生的原因可用化学方程式表示为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X(g)+Y(g) ![]() 2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:从t2→t3的曲线变化是由哪种条件引起的
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:从t2→t3的曲线变化是由哪种条件引起的

A. 增大X或Y的浓度 B. 增大压强
C. 增大Z的浓度 D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )

A. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
B. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
C. H2(g)+I2(g)![]() 2HI(g) ΔH>0
2HI(g) ΔH>0
D. 2NH3(g)![]() N2(g)+3H2(g) ΔH>0
N2(g)+3H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙 醇 | -114 | 78.4 | 0.79 |
乙 酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓H2SO4 | 338 | 1.84 |



实验室制取乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比2:3:2的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到盛有10mL饱和Na2CO3溶液的(加入2滴酚酞试液)试管中;③小火加热试管中的混合液;④待小试管中收集约2mL产物时停止加热,撤出小试管并用力振荡,然后静置;⑤分离出纯净的乙酸乙酯。请回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是_____________________________;
(2)写出该实验制取乙酸乙酯的化学方程式_________________________________,浓H2SO4的作用是 _______________________;
(3)步骤③中,用小火加热试管中的混合液,其原因_________________________;
(4)步骤④所观察到的现象是___________________________________________________
(5)步骤⑤中,分离出乙酸乙酯的方法是_________________________________;
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取圆底烧瓶中产物)。你认为哪种装置更合理,为什么?_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com