
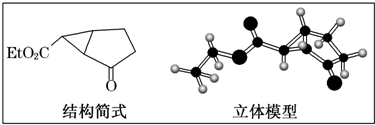


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
| A、需要加热才能发生的反应一定是吸热反应 |
| B、化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C、反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
| D、化学反应中的能量变化通常表象为热量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
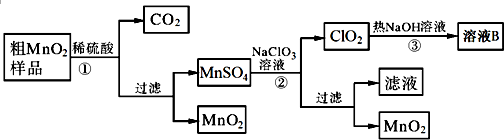
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
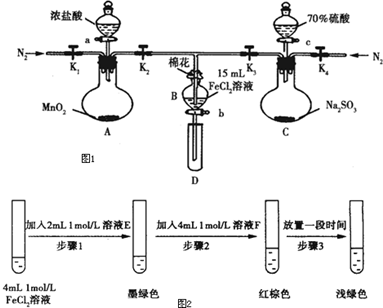
| 过程ⅣB中溶液含有的离子 | 过程ⅥB中溶液含有的离子 | |
| 甲 | 有Fe2+,无Fe3+ | 有SO42- |
| 乙 | 既有Fe3+,又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+,无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2+2H2O |
| B、Cu片插入FeCl3溶液中:Cu+Fe3+═Fe2++Cu2+ |
| C、向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、向 NaHSO4溶液中滴加Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用于消化道检查的钡餐(硫酸钡) |
| B、用SO2漂白食品 |
| C、用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) |
| D、用小苏打(NaHCO3)发酵面团制作馒头 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只用淀粉溶液就可鉴别市售食盐是否为加碘盐 |
| B、淀粉、蚕丝、油脂都属于天然高分子化合物 |
| C、糖类、油脂和蛋白质都是人体所需基本营养物质,都能发生水解反应 |
| D、一定条件下,由葡萄糖可以制得酒精 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com