
【题目】用如图所示装置探究铁粉在高温下与水蒸气反应的实验。

(1)仪器a的名称是__________________。
(2)干燥管C内盛放的药品是___________________。
(3)装置D中的现象是_________________________。
(4)写出铁在高温下与水蒸气反应的化学方程式:_________________________。
(5)当装置B的玻璃管中固体的质量增加16g时,生成H2在标准状况下的体积为______________。
【答案】 圆底烧瓶 无水CaCl2(或P2O5或碱石灰) 黑色固体变红,右端管壁有水珠 3Fe+4H2O(g) ![]() Fe3O4+4H2 22.4L
Fe3O4+4H2 22.4L
【解析】(1)铁粉在高温下与水蒸气反应,则A的作用为提供水蒸气,所用玻璃仪器为圆底烧瓶;(2)C中药品为碱石灰,可干燥氢气;(3)D中是氢气还原氧化铜得到铜和水,所以实验现象是硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;(4)高温下Fe与水蒸气反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;(5)B中反应方程式为3Fe+4H2O(g)
Fe3O4+4H2;(5)B中反应方程式为3Fe+4H2O(g)![]() Fe3O4+4H2,所以B中增重的质量其实就是氧的质量,B的玻璃管中固体的质量增加16g,即氧元素的质量为16g,物质的量为1mol,氧元素来源于水,水中氢原子与氧原子的物质的量之比为2:1,所以氢原子的物质的量为2mol,则参加反应的水有1mol,根据关系式H2O~H2可知产生的氢气为1mol,在标况下的体积为22.4L。
Fe3O4+4H2,所以B中增重的质量其实就是氧的质量,B的玻璃管中固体的质量增加16g,即氧元素的质量为16g,物质的量为1mol,氧元素来源于水,水中氢原子与氧原子的物质的量之比为2:1,所以氢原子的物质的量为2mol,则参加反应的水有1mol,根据关系式H2O~H2可知产生的氢气为1mol,在标况下的体积为22.4L。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】如图是一个简易测量物质反应是吸热还是放热的实验装置。将镁片加入小试管内,然后注入足量的盐酸。

请根据要求回答下列问题:
(1)有关反应的离子方程式是__________________________________。
(2)试管中观察到的现象是__________________________________。
(3)U形管中左端液面 (填“上升”或“下降”),原因是________________________________,说明此反应是______(填“放热”或“吸热”)反应。
(4)由实验推知,MgCl2和H2的总能量____________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:
C6H12O6(s)+6O2(g) ![]() 6CO2(g)+6H2O(l) ΔH=2800 kJ mol1
6CO2(g)+6H2O(l) ΔH=2800 kJ mol1
葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算:
(1)100 g葡萄糖在人体内完全氧化时所产生的热量为_______________。
(2)人的体温一般要保持在36.5°C,低于此温度则要“打寒战”,并靠消耗葡萄糖释放出的能量来维持体温,与此同时有一部分能量转化为ATP。若形成 1 mol ATP需消耗10.75 g葡萄糖,则“打寒战”时会有________ %的能量转化成热量。(已知形成1 mol ATP需消耗75.24 kJ的能量)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是

A. 可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
B. 足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O==2HIO3+10HCl
C. 由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D. 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项操作中,错误的是( )
A.用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
B.进行分液时,分液漏斗中的下层液体,从下端流出,上层液体则从上口倒出
C.萃取、分液前需对分液漏斗进行检漏
D.将上面的塞子拿下,可以保证分液漏斗内的液体顺利流出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B两种气体在一定条件下可以发生反应:2A+B![]() C+3D,现将2 mol A气体与1 mol B气体充入一个密闭容器中,温度和压强恒定的情况下,测得反应后气体体积为反应前的一半,且测得放出的热量为198 kJ,则下列热化学方程式可能正确的是( )
C+3D,现将2 mol A气体与1 mol B气体充入一个密闭容器中,温度和压强恒定的情况下,测得反应后气体体积为反应前的一半,且测得放出的热量为198 kJ,则下列热化学方程式可能正确的是( )
A. 2A(g)+B(g) ![]() C(g)+3D(g) ΔH=-198kJ·mol-1
C(g)+3D(g) ΔH=-198kJ·mol-1
B. C(g)+3D(l) ![]() 2A(g)+B(g) ΔH=+198kJ·mol-1
2A(g)+B(g) ΔH=+198kJ·mol-1
C. 2A(g)+B(g) ![]() C(g)+3D(l) ΔH=-198kJ·mol-1
C(g)+3D(l) ΔH=-198kJ·mol-1
D. C(g)+3D(l) ![]() 2A(g)+B(g) ΔH=+264kJ·mol-1
2A(g)+B(g) ΔH=+264kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

反应的热化学方程式为____________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJmol1,H—H键的键能是436.0 kJmol1, N—H键的键能是391.55 kJmol1,则![]() N2(g)+
N2(g)+![]() H2(g)NH3(g)
H2(g)NH3(g)
ΔH=_____________________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)CO2(g) ΔH1=393.5 kJmol1
② 2H2(g)+O2(g)2H2O(l) ΔH2=571.6 kJmol1
③ 2C2H2(g)+5O2(g)4CO2(g)+2H2O(l) ΔH3=2599 kJmol1
298 K时反应2C(s,石墨)+H2(g)C2H2(g)的焓变:ΔH=_____________________。
(4)已知:铝热反应是放热反应,又知,常温下: 4Al(s)+3O2(g)2Al2O3(s) ΔH1
4Fe(s)+3O2(g)2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是_____________。
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料。下列说法正确的是( )
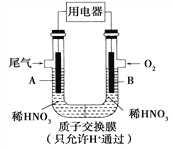
A. 电解质溶液中电流的方向由B到A,电子的流向与之相反
B. 电极A表面反应之一为NO-3e-+2H2O===NO![]() +4H+
+4H+
C. 电极B附近的c(NO![]() )增大
)增大
D. 该电池工作时,每转移4 mol电子,生成22.4 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则原混合溶液中钾离子物质的量浓度为( )
A. 0.1(b-2a)mol/L B. 10(2a-b)mol/L
C. 10(b-a)mol/L D. 10(b-2a)mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com