
| 编号 | 实验内容 | 实验操作 | 预期现象和结论 |
| ① | 检验黄色溶液A中是否含有Fe2+ | ||
| ② | 检验绿色溶液C中是否含有Fe3+ |
| 编号 | 实验内容 | 实验操作 | 预期现象和结论 |
| ① | 检验黄色溶液A中是否含有Fe2+ | 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ |
| ② | 检验绿色溶液C中是否含有Fe3+ | 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 | 溶液出现血红色,则绿色溶液C仍有Fe3+ |


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:阅读理解



| 氢氧化物开始沉淀时的PH | 氢氧化物沉淀完全时的PH | |
| Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
| 编号 | 实验内容 | 实验操作 | 预期现象和结论 |
| ① | 检验黄色溶液A中是否含有Fe2+ | 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 |
酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ 酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ |
| ② | 检验绿色溶液C中是否含有Fe3+ | 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 |
溶液出现血红色,则绿色溶液C仍有Fe3+ 溶液出现血红色,则绿色溶液C仍有Fe3+ |
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修6 2.2 物质的制备练习卷(解析版) 题型:填空题
铁是与日常生活密切相关的元素。
(1)在生铁中含有一种铁、碳化合物X。已知X中铁、碳的元素质量比为14∶1。X的最简式为__________。
(2)X有下列转化关系:(无关物质已经略去)

溶液甲中含有的大量阳离子是________________;溶液甲中加入H2O2发生反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(3)X与过量浓硝酸反应生成气体Z和气体W,Z是一种无色无味能使澄清石灰水变浑浊的气体,气体Z和W分别是:Z__________、W__________。
(4)Fe(OH)3胶体外观与Fe(SCN)3溶液相似,请设计一种简单的方法将它们鉴别出来且不破坏它们:________________________。
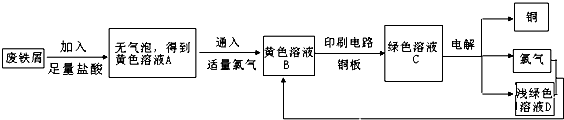
(5)某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜。活动过程如下:

①写出废铁屑与盐酸反应的离子方程式:
________________________________________________________________________。
②学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
|
实验内容 |
实验操作 |
预期现象和结论 |
|
检验黄色溶液A中是否含有Fe2+ |
|
|
|
检验绿色溶液C中是否含有Fe3+ |
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com