
常温下,pH都等于9的NaOH溶液和CH3COONa两种溶液中,若由水电离产生OH- 浓度分别为a mol/L和b mol/L,则a和b的关系是
A.a>b B.a=10-4b C.b=10-4a D.a=b
B
【解析】
试题分析:根据H2O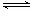 H++OH-,从影响水的电离平衡移动的角度分析,NaOH抑制水的电离,CH3COONa促进水的电离,据此可以解答。pH=9的NaOH溶液,由NaOH电离产生的c(OH-)=10-5mol/L,则由水电离产生的c(OH-)=c(H+)=
H++OH-,从影响水的电离平衡移动的角度分析,NaOH抑制水的电离,CH3COONa促进水的电离,据此可以解答。pH=9的NaOH溶液,由NaOH电离产生的c(OH-)=10-5mol/L,则由水电离产生的c(OH-)=c(H+)=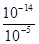 mol/L=10-9mol/L,即a=10-9mol/L;pH=9的CH3COONa溶液促进水的电离,OH-全部由水电离产生,c(OH-)=10-5mol/L,即b=c(OH-)=10-5mol/L,所以a:b=10-9mol/L:10-5mol/L=10-4,即a=10-4b,答案选B。
mol/L=10-9mol/L,即a=10-9mol/L;pH=9的CH3COONa溶液促进水的电离,OH-全部由水电离产生,c(OH-)=10-5mol/L,即b=c(OH-)=10-5mol/L,所以a:b=10-9mol/L:10-5mol/L=10-4,即a=10-4b,答案选B。
考点:考查水的电离、离子积常数和pH的计算


科目:高中化学 来源: 题型:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.A>B B.A=10-4B C.B=10-4A D.A=B
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为A mol·L-1与B mol·L-1,则A与B的关系为( )
A.A>B B.A=10-4 B
C.B=10-4A D.A=B
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com