
| A. | 所得液体属于纯净物 | B. | 该红褐色液体能产生了达尔效应 | ||
| C. | 所得液体中分散质粒子只有Fe(OH)3 | D. | 上述实验过程中没有发生化学变化 |
分析 向100mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,得到Fe(OH)3胶体,方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,胶体粒子是大量氢氧化铁的聚集体,根据胶体的性质解答;
解答 解:向100mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,得到Fe(OH)3胶体,
A、胶体中含有分散质、分散剂,属于混合物,故A错误;
B、胶体具有丁达尔效应,当用激光笔照射时,会有一道明亮的光路,故B正确;
C、胶体粒子是大量氢氧化铁的聚集体,不是只有Fe(OH)3,故C错误;
D、上述实验过程中发生化学反应:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,故D错误;
故选B.
点评 本题考查了胶体的制备和胶体的性质,易错点为胶体的制备,注意制备方法.


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:推断题
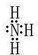 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(g)△H=-48.40 kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=+5518 kJ•mol-1 | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-48.40 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
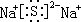 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
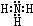 ,B的结构式为
,B的结构式为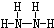 .
.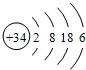 .
.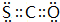 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
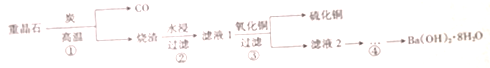
| A. | 步骤①中BaSO4作氧化剂 | |
| B. | 步骤②所得滤液1呈中性 | |
| C. | 步骤③中发生复分解反应 | |
| D. | 步骤④的实验操作中不需要用到石棉网、坩埚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使溴水褪色,这表现了SO2的漂白性 | |
| B. | 钠钾合金可用于快中子反应堆的热交换剂 | |
| C. | 氨的水溶液能导电,所以氨是强电解质 | |
| D. | 按a、b两种途径制备等量的硝酸镁,消耗的二种酸的物质的量不同 途径a:Mg$→_{△}^{O_{2}}$MgO$\stackrel{稀硝酸}{→}$Mg(NO3)2 途径b:Mg$\stackrel{浓硫酸}{→}$MgSO4$\stackrel{Ba(NO_{3})_{2}溶液}{→}$Mg(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com