
| A. | 若误饮c(Ba2+)=1.0×10-5mol/L溶液时,不会引起Ba2+中毒 | |
| B. | 因为Ksp(BaCO3)>Ksp(BaSO4),所以BaCO3不能作内服造影剂 | |
| C. | 向同浓度Na2SO4和Na2CO3的混合溶液中滴加BaCl2溶液,BaSO4先析出 | |
| D. | 在BaSO4和BaCO3共存的悬浊液中,c(SO42-):c(CO32-)=1:51 |
分析 A.c(Ba2+)=1.0×10-5 mol•L-1的溶液钡离子浓度很小;
B.BaCO3可溶于盐酸;
C.化学式相似的物质Ksp小的容易生成沉淀;
D.根据Ksp(BaSO4 和Ksp(BaCO3)计算可求出.
解答 解:A.c(Ba2+)=1.0×10-5 mol•L-1的溶液,钡离子浓度很小,不会引起钡离子中毒,故A正确;
B.BaCO3可溶于盐酸,可引入钡离子中毒,与溶度积大小无关,故B错误;
C.25℃时,Ksp(BaSO4)=1×10-10,Ksp (BaCO3)=5.1×10-9,物质Ksp小的容易生成沉淀,所以同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出,故C正确;
D.根据Ksp(BaSO4 )和Ksp(BaCO3)计算可求出中c(SO42-):c(CO32-)=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=1:51,故D正确.
故选B.
点评 本题考查了沉淀之间的转化,沉淀溶解平衡的移动,Ksp的有关计算,综合性较强,题目难度中等,注意把握沉淀溶解平衡的原理及影响因素是解题的关键.


科目:高中化学 来源: 题型:选择题
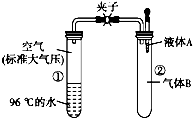 如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 饱和食盐水、氯化氢 | ||
| C. | 氢氧化钠溶液、一氧化碳 | D. | 石灰水、二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| pH | 6.5~6.8 |
| Ca2+、Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.| 操作 | 现象及结论 |
| 基于方案一: | |
| 基于方案二: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
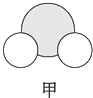 | 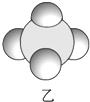 |  |
| 是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
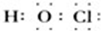 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
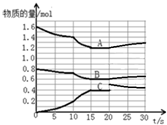 在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )| A. | 反应在前10s 内v(B)=0.005mol/(L.s) | |
| B. | 方程式计量数a:b:c为2:1:2 | |
| C. | 10 s时改变条件可能是升高温度,20s时平衡逆向进行 | |
| D. | 15~20s间,反应的平衡常数是2.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
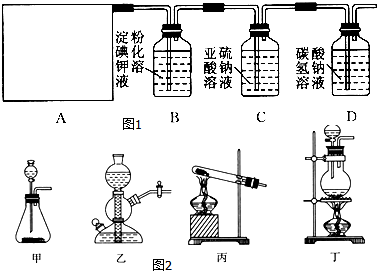
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com