
| A、①②⑤④③ |
| B、①④③②⑤ |
| C、⑤②①④③ |
| D、②①⑤④③ |


 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
| A、加NaOH |
| B、通入H2S气体 |
| C、降温 |
| D、加入Na2S晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、Na+、Cl-、SCN- | ||
B、HCO3-、Ca2+、C
| ||
| C、Na+、AlO2-、NO3-、H+ | ||
| D、K+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若为盐酸溶液,pH减小 |
| B、若为氢氧化钠溶液,pH减小 |
| C、若为硫酸钠溶液,pH不变 |
| D、若为氯化钠溶液,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表是学习化学的一种重要工具.A、B、C、D、E、F是周期表中前四周期的六种元素,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F有+1、+2两种常见的化合价,其单质为红色.回答下列问题:
元素周期表是学习化学的一种重要工具.A、B、C、D、E、F是周期表中前四周期的六种元素,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F有+1、+2两种常见的化合价,其单质为红色.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
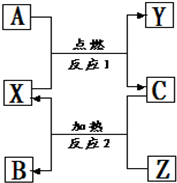 A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答:
A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,32克氧气中原子个数为NA |
| B、标准状况下,1mol H2O的体积为22.4L |
| C、常温常压下,1mol H2的质量为2克 |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有的Cl-数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com