
【题目】烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1 NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1 SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
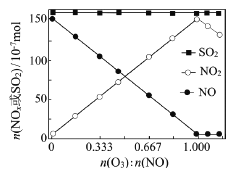
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见右图。
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是_________________
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是___________________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,溶液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:_________________________________________________________________________________
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=_____________________________[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是__________________________________________________________________
(5)甲醇燃料电池在碱性溶液中的电极反应式。正极_________________________________;负极____________________________________________________________________________
【答案】 -317.3 O3将NO2氧化成更高价氮氧化物 SO2与O3的反应速率慢 SO32-+2NO2+2OH-=SO42-+2NO2-+H2O Ksp(CaSO3)×c(SO42-)/Ksp(CaSO4) CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率 3O2 + 6H2O + 12e- = 12OH- 2CH3OH - 12e- + 16OH- = 2CO32- + 12H2O
【解析】(1)设NO(g)+O3(g)=NO2(g)+O2(g) △H1=-200.9kJ·mol-1 ①
NO(g)+1/2O2(g)=NO2(g) △H2=-58.2kJ·mol-1 ②
根据盖斯定律推知,3NO(g)+O3(g)=3NO2(g) △H3=①+2×②=-317.3mol·L-1;
(2)①O3氧化性强,当n(O3):n(NO)>1时,过量的O3可将NO2进一步氧化为更高价氮氧化物(或生成了N2O5);②根据图像可观察到,增加O3的物质的量,SO2的含量变化不大,可能是SO2与O3的反应速率慢,使得O3的含量对该反应的反应速率影响不大。
(3)根据题意,pH约为8的溶液中SO32- 将NO2转化为NO2-,N元素化合价由+4变为+3,被还原,则SO32-被氧化,生成SO42-,根据电子守恒,n(SO32-) :n(NO2)=1:2,可知还需要OH-参与反应,该化学反应方程式为SO32-+2 NO2+2OH-= SO42-+ 2NO2-+H2O;
(4)CaSO3水悬浮液中加入Na2SO4溶液,离子反应方程式为CaSO3+SO42-![]() CaSO4+SO32-,平衡常数,即
CaSO4+SO32-,平衡常数,即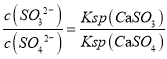 ,故
,故![]() ;根据离子反应方程式可知加入Na2SO4溶液,CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率;
;根据离子反应方程式可知加入Na2SO4溶液,CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率;
(5)甲醇燃料电池在碱性溶液中的电极反应式,正极:3O2 + 6H2O+12e-=12OH-,负极:2CH3OH-12e-+16OH-= 2CO32-+ 12H2O。


科目:高中化学 来源: 题型:
【题目】已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+ ![]() O2(g)△H=+242kJmol﹣1
O2(g)△H=+242kJmol﹣1
B.2H2(g)+O2(g)=2H2O(l)△H=﹣484kJmol﹣1
C.H2(g)+ ![]() O2(g)=H2O(g)△H=+242kJmol﹣1
O2(g)=H2O(g)△H=+242kJmol﹣1
D.2H2(g)+O2(g)=2H2O(g)△H=+484kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】250mL K2SO4和CuSO4的混合溶液中c(SO ![]() )=0.5molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
)=0.5molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
A.电解得到Cu的质量为3.2 g
B.上述电解过程中共转移电子0.2 mol
C.电解后的溶液中c(H+)=0.2 molL﹣1
D.原混合溶液中c(K+)=0.6 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存.
(1)一定温度下,向1L 0.1molL﹣1CH3COOH溶液中加入0.1mol CH3COONa固体,溶液中 ![]() (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 .
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 .
(2)常温下向20mL 0.1molL﹣1Na2CO3溶液中逐滴加入0.1molL﹣1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:回答下列问题: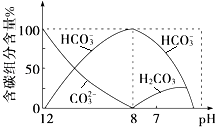
①在同一溶液中,H2CO3、HCO ![]() 、CO
、CO ![]() (填“能”或“不能”)大量共存;
(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有、 , 溶液中含量最多的三种微粒的物质的量浓度的大小关系为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.4 g Al 投入到200.0 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
A. HNO3溶液 B. Ba(OH)2溶液 C. H2SO4溶液 D. HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[ Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝
酸钙,实验装置如图所示(夹持装置略去)。
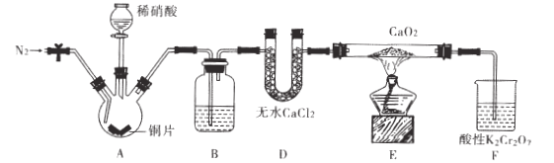
已知:![]()
请回答下列问题:
(1)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2,原因是____。
(2)仪器D的名称是_;B中盛放的试剂是____。
(3)装置F中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO3-,溶液由橙色变为绿色
(Cr3+),发生反应的离子方程式是____。
(4)已知Ca(NO2)2溶液需保持弱碱性,因为其遇酸会发生反应,产生NO气体。设计
实验证明E中有亚硝酸钙生成____。
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、N02)反应,既能净化尾气,又能获得
应用广泛的Ca(NO2)2,反应原理为Ca(OH)2+NO +N02=Ca(N02)2+H2O。
①若n( NO):n(NO2)>l:l,则会导致 :
②若n( NO):n( NO2)<l l,则会导致 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种常用的净水剂,某化学小组同学用如下装置制备无水FeCl3。已知无水FeCl3在空气中易潮解,加热易升华。请回答下列问题:
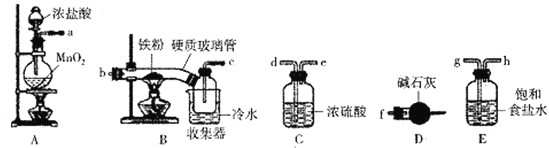
(1)装置A中发生的离子反应方程式为_______________________________。
(2)装置接口的连接顺序为____________ (用a、b、c……h表示)。
(3)装置B中收集器放在冷水中的作用为______________________。
(4)反应结束后,该小组同学对装置B中硬质玻璃管的右端进行加热,其目的是_________________。
(5)反应结束后,该小组同学将装置B中的残留物投入到足量盐酸中溶解.对所得溶液进行如下实验研究,请完成下表实验设计(药品自选)。
实验步骤 | 实验现象 | 实验结论 |
①取少许上述溶液,加入KSCN溶液 | ______ | 含有Fe3+ |
②取少许上述溶液,加入______ | 紫色溶液逐渐变浅至褪色 | _____ |
(6)工业上可用5.0mol·L-1的FeCl3溶液吸收H2S气体,若要吸收170gH2S气体;则需要该FeCl3溶液的体积为____________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li-Cu-空气燃料电池的原理示意如图,电池通入空气腐蚀铜电极而产生正极反应物Cu2O。下列有关说法正确的是
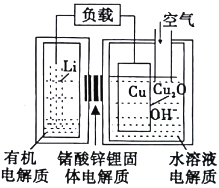
A. 电池工作时,正极上有金属锂析出
B. 电池工作时,负极区溶液中c(OH-)增大
C. 电池放电过程中的总反应为:2Cu+2Li++2OH-=2Li+Cu2O+H2O
D. 停止通入空气一段时间,电池将停止放电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com