
【题目】常温下,用pH=m的盐酸滴定20mLpH=n的MOH溶液,且m+n=14。混合溶液的pH与盐酸体积 (V)的关系如图所示。下列说法正确的是

A. Kb(MOH)的数量级为10-11 B. 由c点可算得m=![]()
C. a点:c(Cl-)>c(M+)>c(OH-)>(H+) D. b点溶液呈中性,此时c(Cl-)=c(M+)
【答案】D
【解析】常温下,用pH=m的盐酸滴定20mLpH=n 的MOH溶液,且m+n=14,则盐酸中氢离子浓度与MOH中氢氧根离子浓度相等,因为盐酸为强酸,且加入20mL 盐酸时溶液呈碱性,说明MOH为弱碱,则MOH的浓度大于盐酸;根据c点可知,盐酸和弱碱恰好完全反应,所以c(MOH)×20×10-3=10×40×10-3, c(MOH)=2×10-m mol/L;由于m+n=14,n-14=-m;所以当MOH达到电离平衡时,c(MOH)平衡 =2×10-m-10-m=10-m mol/L,电离平衡常数为 Kb(MOH)=c(OH-)×c(M+)/c(MOH) 平衡=10n-14×10n-14/10-m =10-m,由于pH=m是盐酸溶液,所以m小于7,即 Kb(MOH)的数量级大于10-11,A错误;c点溶液为MCl溶液,溶液的浓度为:![]() ×10-m =
×10-m =![]() ×10-m mol/L, 溶液水解显酸性,溶液pH=4,c(H+)=10-4 mol/L,由于水解过程微弱,所以10-m>10-4,m<4,不能为m=
×10-m mol/L, 溶液水解显酸性,溶液pH=4,c(H+)=10-4 mol/L,由于水解过程微弱,所以10-m>10-4,m<4,不能为m=![]() ,B错误;a点溶液为碱性,则,c(OH-)>c(H+)根据电荷守恒可以知道c(Cl-)<c(M+),溶液中正确的离子浓度大小为: c(M+)> c(Cl-)>c(OH-)>(H+) , C错误;b点溶液的pH=7,呈中性,则溶液中一定满足: c(H+)= c(OH-),根据电荷守恒:c(H+)+c(M+)=c(OH-)+c(Cl-),所以c(Cl-)=c(M+),D正确;正确选项 D。
,B错误;a点溶液为碱性,则,c(OH-)>c(H+)根据电荷守恒可以知道c(Cl-)<c(M+),溶液中正确的离子浓度大小为: c(M+)> c(Cl-)>c(OH-)>(H+) , C错误;b点溶液的pH=7,呈中性,则溶液中一定满足: c(H+)= c(OH-),根据电荷守恒:c(H+)+c(M+)=c(OH-)+c(Cl-),所以c(Cl-)=c(M+),D正确;正确选项 D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
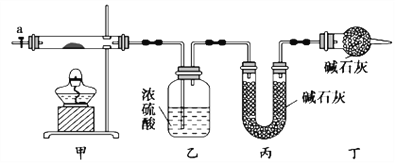
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_______________。
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_______(填字母)连接在__________(填装置连接位置)。
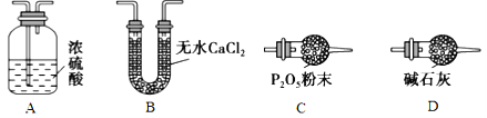
(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______________。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
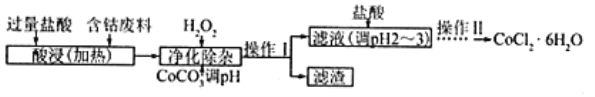
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2发生反应的离子方程式为_____________。
②加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________________。
③加盐酸调整pH为2~3的目的为_________________。
④操作Ⅱ过程为_______________(填操作名称)、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。

请回答:
(1)密闭容器的体积是____________L;
(2)若t1=15,则0-t1s内C物质的浓度变化表示的平均反应速率v(C)=________________;
(3)写出反应的化学方程式:____________________________________________;
(4)t1时,A的转化率为_________,第7s时v(A)正_____v(B)逆(填“<”、“>”或“=”);
(5)B的起始物质的量是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道,能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺流程如下:

(1)“分子筛”的化学式用氧化物形式可表示为_______________。
(2)铝灰水解产生的气体为________(填化学式),该气体分子中极性键的数目为___________;“水解”在加热条件下而不在室温下进行的原因是________________________。
(3)“酸溶”时,发生氧化还原反应的离子方程式为_________________________________。
(4)该工艺中滤渣的颜色为________________________。
(5)某学习小组设计实验模拟从浓缩海水(含Ca2+、Mg2+、SO42-)中提取试剂级NaCl:
![]()
①实验中若向浓缩海水中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2CO3生成,同时有气体逸出。该反应的离子方程式为__________________________________。
②该学习小组发现上述实验即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。从平衡角度分析其原因:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于体积为1L的密闭容器中,发生如下反应:4A(g)+B(g) =2C(g) 反应进行到4s末,测得A为0.5 mol,B为0.4 mol, C为0.2mol。则用v(A)表示的该反应的速率为 , 用v(B)表示的该反应的速率为 , 用v(C)表示的该反应的速率为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.124g P4含有的P﹣P键数为4NA(设NA表示阿伏伽德罗常数的值)
B.Be和NaOH溶液反应的离子方程式是:2Be+2OH ﹣+2H2O=2BeO2﹣+3H2↑
C.在NaCl溶液中加入AgNO3溶液,生成白色沉淀;再加入氨水,沉淀消失,沉淀消失发生的离子方程式是:
AgCl+2NH3H2O=[Ag(NH3)2]++Cl﹣+2H2O
D.0.1mol/L的Fe3+溶液中,能大量共存的离子有Cl﹣、SO42﹣、SCN﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N和Si能形成多种高硬度材料,如Si3N4,C3N4、SiC。
(1) Si3N4和C3N4中硬度较高的是_________,理由是____________________。
(2)C和N能合成三聚氰胺(如图所示),其中N原子的杂化方式为________________。

(3)C和N还能形成一种五元环状有机物咪唑(im),其结构为 。化合物[Co(im)6]SiF6的结构示意图如图所示:
。化合物[Co(im)6]SiF6的结构示意图如图所示:

①基态Co原子的次外层电子排布式为___________。N与Co2+之间的化学键类型是_________________,判断的理由是__________________。
②阴离子[SiF6]2-中心原子Si的价层电子对数为___________________。阳离子[Co(im)6]2+和[SiF6]2-之间除了阴阳离子间的静电作用力,还存在氢键作用,画出该氢键的表示式_______。(例如,水中氢键的表示式为: )。
)。
(4)β-SiC为立方晶系晶体,晶胞参数为a,已知Si原子半径为rSi,C原子半径为rC,该晶胞中原子的分数坐标为:
C:(0,0,0);(1/2,1/2,0);(1/2,0,1/2);(0,1/2,1/2);……
Si:(1/4,1/4,1/4);(1/4,3/4,3/4);(3/4,1/4,3/4);(3/4,3/4,1/4)。
则β-SiC立方晶胞中含有____个Si原子、___个C原子;该晶跑中原子的体积占晶胞体积的百分率为______________(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com