
【题目】次氯酸钠是常见的消毒剂,实验室可用以下两种方法来制取次氯酸钠溶液:
方法一:向装有NaOH的溶液中通入氯气(装置如图所示);

方法二:向Na2CO3溶液中加入Ca(ClO)2,反应后过滤。
(1)写出方法一所发生反应的离子方程式___。
(2)NaOH溶液和氯气的反应为放热反应,随着温度的升高,会有副反应发生。为防止副反应的发生,可以采取的方法是___。
(3)方法二与方法一相比,优点除无副反应发生外,还有___、___。
(4)某次氯酸钠粗产品中混有的杂质为NaClO3,为测定粗产品中NaClO的质量分数,现进行如下实验:称取0.6173g样品于锥形瓶中,加水使样品完全溶解,向溶液中加入适量硫酸酸化,接着加入40mL0.5000mol·L-1的FeSO4溶液(过量),充分反应。再向锥形瓶中滴加0.0200mol·L-1的KMnO4溶液,恰好完全反应时消耗KMnO4溶液体积28.00mL。请计算样品中NaClO的质量分数(写出计算过程)。___
已知实验过程中发生的反应如下:
H++ClO-+Fe2+→Cl-+Fe3++H2O
H++ClO3-+Fe2+→Cl-+Fe3++H2O
H++MnO4-+Fe2+→Mn2++Fe3++H2O(以上反应均未配平)
【答案】Cl2+2OH-=ClO-+Cl-+H2O 将烧杯置于冰水浴中(或缓慢通入Cl2) 不使用有毒物质,不会污染空气 不含杂质(或杂质少) 96.55%
【解析】
(1)方法一为向装有NaOH的溶液中通入氯气,氯气和氢氧化钠反应生成氯离子和次氯酸跟,离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O;
(2)要减少副反应的发生就是要降低反应体系的温度,方法有缓慢滴加盐酸、将装置C置于冰水中;
(3)方法二向Na2CO3溶液中加入Ca(ClO)2,没有使用有毒气体氯气,不会污染空气,并且生成物除次氯酸钠还有碳酸钙沉淀,容易出去,杂质少;
(4)消耗KMnO4物质的量:0.0200mol·L-1×0.028L=0.00056mol,由得失电子守恒可知与高锰酸钾反应的Fe2+物质的量:0.00056mol×5=0.0028mol,总物质的量:0.5000mol·L-1×0.04L=0.02mol,与样品反应的Fe2+总物质的量,0.02mol-0.0028mol=0.0172mol,极限法讨论:0.6173g样品全为NaClO,2n(NaClO)=n(Fe2+)=2×(0.6173g÷74.5g/mol)=0.01657mol,0.6173g样品全为NaClO3,6n(NaClO3)=n(Fe2+)=6×(0.6173g÷106.5g/mol)=0.03478mol,0.6173g样品全为NaCl,不消耗Fe2+,故样品中含的杂质为NaClO3,列方程得:74.5 n(NaClO)+106.5 n(NaClO3)=0.6173,2n(NaClO)+6 n(NaClO3)=0.0172,解方程可以求得n(NaClO)。
(1)方法一为向装有NaOH的溶液中通入氯气,氯气和氢氧化钠反应生成氯离子和次氯酸跟,离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O;
(2)要减少副反应的发生就是要降低反应体系的温度,方法有缓慢滴加盐酸、将装置C置于冰水中;
(3)方法二向Na2CO3溶液中加入Ca(ClO)2,没有使用有毒气体氯气,不会污染空气,并且生成物除次氯酸钠还有碳酸钙沉淀,容易出去,杂质少,故答案为:不使用有毒物质,不会污染空气;
(4)消耗KMnO4物质的量:0.0200mol·L-1×0.028L=0.00056mol,由得失电子守恒可知与高锰酸钾反应的Fe2+物质的量:0.00056mol×5=0.0028mol,总物质的量:0.5000mol·L-1×0.04L=0.02mol,与样品反应的Fe2+总物质的量,0.02mol-0.0028mol=0.0172mol,极限法讨论:0.6173g样品全为NaClO,2n(NaClO)=n(Fe2+)=2×(0.6173g÷74.5g/mol)=0.01657mol,0.6173g样品全为NaClO3,6n(NaClO3)=n(Fe2+)=6×(0.6173g÷106.5g/mol)=0.03478mol,0.6173g样品全为NaCl,不消耗Fe2+,故样品中含的杂质为NaClO3,列方程得:74.5 n(NaClO)+106.5 n(NaClO3)=0.6173,2n(NaClO)+6 n(NaClO3)=0.0172,解得n(NaClO)=0.008
W(NaClO)=(![]() )×100%=96.55%;
)×100%=96.55%;


科目:高中化学 来源: 题型:
【题目】药物阿莫西林能杀灭或抑制细菌繁殖,它的合成路线如下:
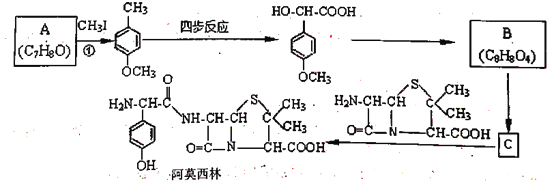
已知:1.两个羟基同时连在同一个碳原子上的结构是不稳定的,它将发生脱水反应
![]()
![]()
![]() +H2O
+H2O
2.RCHO![]()
![]()
![]()
![]()
(1)关于阿莫西林分子,下列说法正确的是_______________。
A.分子式为C16H18N3O5 B.分子中含4个手性碳原子
C.1 mol该物质最多能与3mol NaOH反应 D.能发生取代、加成、氧化、缩聚等反应
(2)反应①的化学方程式为_______________,CH3I的作用为__________。
(3)写出甘氨酸(H2N-CH2-COOH)和C发生缩合生成二肽的结构简式: ________。
(4)试写出3种同时满足下列条件的化合物C的同分异构体:___________。
①分子中含苯环,不含过氧键“-O-O-”;
②分子中含有3种不同化学环境的氢原子。
(5)利用己有知识和题中涉及的反应,设计从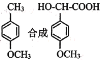 的路线。(用流程图表示,无机试剂任选)__________________
的路线。(用流程图表示,无机试剂任选)__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据官能团可以对有机物进行分类、鉴别和除杂。
①下列有机物属于烃的是___(填字母)。
a.乙炔 b.乙醇 c.乙酸
②区分甲苯和苯,可用的试剂是___(填字母)。
a.FeCl3溶液 b.酸性KMnO4溶液 c.溴水
③除去乙酸乙酯中的乙酸,可用的试剂是___(填字母)。
a.NaOH溶液 b.NaCl溶液 c.饱和Na2CO3溶液
(2)异丙苯是一种重要的有机化工原料。异丙苯的结构简式为![]() 。
。
①异丙苯中最多有___个碳原子共平面,其核磁共振氢谱上有___个峰。
②异丙苯氧化后可制取分子式为C6H6O的芳香族化合物,该化合物的结构简式是___。
③异丙苯制备对溴异丙苯的化学方程式为___。
(3)化合物III是一种合成医药的中间体,其合成路线如下:
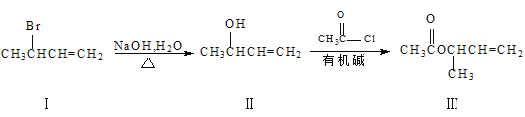
①III中所含官能团的名称是___和___。
②该合成路线中第二步反应属于___反应(填反应类型)。
③I、Ⅱ、Ⅲ三种物质中,与浓硫酸共热能得到CH2=CHCH=CH2的是___(填序号)。物质Ⅱ在Cu作催化剂及加热条件下与O2反应可得产物为___。
④Ⅲ的一种同分异构体X能发生银镜反应,不能发生水解反应,分子中有3种不同化学环境的氢。X的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某恒容的密闭容器中,建立化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。下列叙述不能说明该反应已达到化学平衡状态的是( )
CO(g)+H2(g)。下列叙述不能说明该反应已达到化学平衡状态的是( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成nmolCO,同时生成nmolH2
D.断裂1molH—H键的同时断裂2molH—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) ![]() 2XY3(g) △H=-92.6kJ/mol
2XY3(g) △H=-92.6kJ/mol
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol/L
C. 容器②中反应达到平衡时放出的热量为23.15kJ
D. 若容器①体积为0.20 L,则达平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g) ![]() 3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
A.4molA+2molB B.3molC+1molB+1molD+1molA
C.2molA+1molB+1molD D.1molA+0.5molB + 1.5molC+0.5molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应: PCl3(g)+Cl2(g)![]() PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.40molB.0.20mol
C.小于0.20molD.大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)![]() 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A. 2.5mol C B. 2 mol A、2 mol B和10 mol He(不参加反应)
C. 1.5 mol B和1.5 mol C D. 2 mol A、3 mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知NaOH(aq)+HCl(aq)=![]()
![]() H=-57.3
H=-57.3![]() 则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B.已知2H2(g)+O2(g)=2H2O(g) ![]() H=-483.6
H=-483.6![]()
![]() 则氢气的燃烧热为241.8
则氢气的燃烧热为241.8![]()
C.已知![]() =
=![]()
![]() H=a
H=a![]()
![]() ===2CO(g)
===2CO(g)![]() H=b
H=b![]() 则a>b
则a>b
D.已知P(白磷,s)=P(红磷,s)![]() H<0,则白磷比红磷稳定
H<0,则白磷比红磷稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com