
在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置 ;D元素基态原子电子排布式为_______________。
(2)E的气态氢化物在同族元素中沸点最高的原因是: 。
(3)A、C两元素第一电离能 > 。(填元素符号)
(4)B元素能形成多种配合物。元素之间形成配合物的条件是:一方是能够提供孤对电子的原子,另一方是 的原子。
(5)A元素可与氢元素形成离子化合物,电子式为_______________;这种离子化合物可与水反应,化学方程式为________________________________。
(13分)(1)第4周期第IIB族 (2分) 1s22s22p63s23p63d104s24p5或[Ar] 3d104s24p5(2分)
(2)E的气态氢化物分子间含有氢键,破坏它需要较高的能量,所以熔沸点较高(2分)
(3)Ca K(1分)
(4)具有能够接受孤对电子的空轨道(2分)
(5) [H:]-Ca2+[:H] - (2分) CaH2+2H2O=Ca(OH)2+2H2↑(2分)
【解析】根据元素的电子层结构及有关性质可知,A、B、C、D、E五种元素分别是Ca、Zn、K、Br、F。
(1)锌位于第4周期第IIB族 。根据构造原理可知,Br的电子排布式为1s22s22p63s23p63d104s24p5。
(2)HF分子间含有氢键,破坏它需要较高的能量,所以熔沸点较高。
(3)钙元素的4s电子属于全充满状态,稳定性强,所以第一电离能大于K的。
(4)考查配位键的形成条件。
(5)氢化钙是离子化合物,电子式为[H:]-Ca2+[:H] -。和水反应生成氢氧化钙和氢气,方程式为CaH2+2H2O=Ca(OH)2+2H2↑。


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
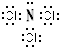
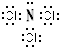
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
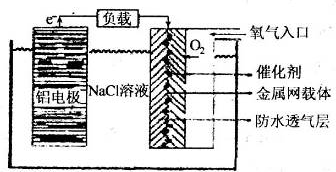 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示:请回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com