
| A. | 判断过程发生的速率 | B. | 确定过程是否一定会发生 | ||
| C. | 判断过程的方向 | D. | 判断过程的热效应 |
科目:高中化学 来源: 题型:解答题
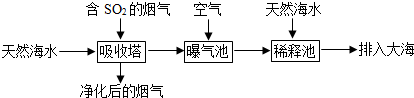
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的摩尔质量是64g | |
| B. | 1molSO2中含氧原子数约为6.02×1023 | |
| C. | 常温常压下,1molSO2的体积为22.4L | |
| D. | 常温常压下,64gSO2的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol O2和4mol NO2 | B. | 1mol O2和4mol NO | ||
| C. | 1mol NO和5mol NO2 | D. | 4mol NO和1mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 等物质的量的甲、乙、丙分别与足量钠反应,乙放出气体最多 | |
| B. | 甲、乙、丙均能与Fe3+显色 | |
| C. | 甲和丙互为同分异构体 | |
| D. | 甲、乙、丙苯环上的一溴代物均为4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27% | B. | 28% | C. | 54% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含有共价键的物质都是共价化合物 | |
| B. | 共价化合物中一定没有离子键 | |
| C. | 凡是在水溶液中能电离出离子的化合物都是离子化合物 | |
| D. | 离子化合物中一定没有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
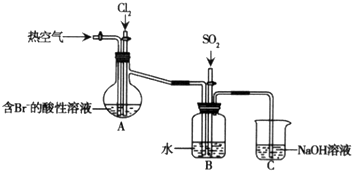
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com