
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
实验编号 反应物 催化剂
① 10mL2% H2O2溶液 无
② 10mL5% H2O2溶液 无
③ 10mL5% H2O2溶液 1mL0.1mol•L﹣1FeCl3溶液
④ 10mL5% H2O2溶液+少量HCl溶液 1mL0.1mol•L﹣1FeCl3溶液
⑤ 10mL5% H2O2溶液+少量NaOH溶液 1mL0.1mol•L﹣1FeCl3溶液
(1)催化剂能加快化学反应速率的原因是 .
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为 .
(3)实验①和②的目的是 .实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是 ).
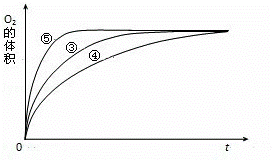
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.
分析上图能够得出的实验结论是 .
考点: 化学反应速率的影响因素;催化剂的作用.
专题: 化学反应速率专题.
分析: (1)催化剂改变反应的途径,降低反应所需的活化能;
(2)pH约为6,则电离生成氢离子,溶液显酸性;
(3)实验①和②的浓度不同;为了便于比较,应在相同的条件下利用一个变量来比较;
(4)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答.
解答: 解:(1)催化剂改变反应的途径,降低反应所需的活化能,从而加快反应速率,故答案为:降低了活化能;
(2)pH约为6,则电离生成氢离子,溶液显酸性,其电离方程式为H2O2⇌H++HO2﹣,故答案为:H2O2⇌H++HO 2﹣;
2﹣;
(3)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,
则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中),
故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);
(4)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
点评: 本题考查影响化学反应速率的因素,较好的考查学生实验设计、数据处理、图象分析的综合能力,难度中等,注意信息的利用即可解答.


科目:高中化学 来源: 题型:
下列说法不正确的是()
A. 催化剂可以改变化学反应速率
B. 2 mol SO2与l mol O2混合一定能生成2 mol SO3
C. 食物放在冰箱中会减慢食物变质的速率
D. 化学反应达到反应限度时,正反应的速率与逆反应的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
镁﹣H2O2酸性燃料电池是一种新型燃料电池,采用海水作电解质(加入一定量的酸),下列说法不正确的是()
A. 工作时,正极周围海水的pH增大
B. 电池总反应为:Mg+H2O2=Mg(OH)2
C. 正极发生的电极反应为:H2O2+2H++2e﹣=2H2O
D. 电池工作时,溶液中的H+向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中发生如下反应:mA(g)+nB(g)⇌pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的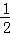 ,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是()
,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是()
A. m+n>p B. 平衡向逆反应方向移动
C. A的转化率提高 D. C的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
将经过酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示装置中,下列叙述正确的是()
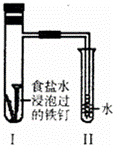
A. 过一段时间,Ⅱ试管中的导管内水柱上升
B. Ⅰ试管中铁钉由于发生电解反应而被腐蚀
C. 铁钉在该装置中被腐蚀的情况随时间的延长而加快
D. Ⅰ试管中铁钉发生反应的一个电极反应式为:2Cl﹣﹣2e﹣═Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
为了除去下列物质中含有的少量杂质(括号中)填写出所用试剂或方法.
(1)CO(CO2) 试剂 ,操作方法的名称 .
(2)Cu粉(Zn粉) 试剂 ,操作方法的名称 .
(3)自来水(Fe3+) 操作方法的名称 .
查看答案和解析>>
科目:高中化学 来源: 题型:
日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
|
| A. | 铜铸塑像上出现铜绿 |
|
| B. | 铁制菜刀生锈 |
|
| C. | 大理石雕像被酸雨腐蚀毁坏 |
|
| D. | 铝锅表面生成致密的氧化膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com