
已知:①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为 221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
| A、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | B、铅蓄电池放电时的负极和充电时的阴极均发生还原反应 | C、已知:H2(g)+I2(g)?2HI(g);△H=-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量 | D、已知在101 kPa时,2 g碳燃烧生成CO放出热量为Q kJ,则碳的燃烧热为6Q kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101 kPa时,32.0 g N2H4在氧气中完全燃烧生成氮气,放出热量624 kJ(25℃时),N2H4完全燃烧反应的热化学方程式是____________________________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质是20%—30%的KOH溶液。写出肼-空气燃料电池放电时正、负极的电极反应式。
正极:________________________________,
负极:________________________________
(3)图2-2-5是一个电化学过程示意图。
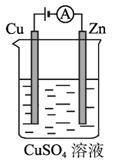
图2-2-5
①锌片上发生的电极反应是________________________________________________。
②假设使用肼?空气燃料电池作为本过程中的电源、铜片的质量变化128 g,则肼-空气燃料电池理论上消耗标标准状况下的空气___________L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。
肼-空气燃料电池放电时:
正极的电极反应式是____________________________________。
负极的电极反应式是____________________________________。
(3)下图是一个电化学过程示意图。

①锌片上发生的电极反应式是____________________________________。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化
(4)传统制备肼的方法,是以NaClO氧化NH3制得肼的稀溶液。该反应的离子方程式是____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省遵化市高二上学期期中质量检测化学试卷(解析版) 题型:选择题
下列说法正确的是
A.蓄电池充电时其负极应与外电源的的正极相连接
B.同温同压下,H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的△H相同
C.已知:H2(g)+I2(g)
 2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量
2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量
D.已知在101 kPa时,2 g碳燃烧生成CO放出热量为Q kJ,则碳的燃烧热为6Q kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014届浙江临海市高一下学期期末模拟化学试卷(解析版) 题型:填空题
(6分)Ⅰ、已知在101 kPa时,CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则CH4完全燃烧反应的热化学方程式是: 。
Ⅱ、在铜片、锌片和400 mL稀硫酸组成的原电池中,若电路中通过0.2 mol电子,H2SO4恰好反应完毕。试计算:
(1)生成气体的体积(在标准状况下);
(2)原400 mL稀硫酸的物质的量浓度(不考虑溶液的体积变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com