
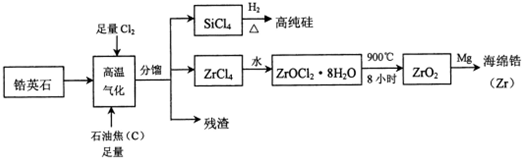
 .
.分析 锆英石(主要成分为ZrSiO4,也可表示为ZrO2•SiO2,还含少量Al2O3、SiO2、Fe2O3等杂质),通入足量的氯气以及和足量的石焦油反应,ZrSiO4转化为ZrCl4,加水水解,使ZrCl4转化为ZrOCl2•8H2O,900℃加热分解,即可得到ZrO2,加入镁置换得到海绵锆,加入镁置换得到海绵锆.
(1)根据在化合物中正负化合价代数和为零,结合ZrSiO4的化学式进行解答;因锆英石含有杂质SiO2,SiO2也能在高温气化条件下反应生成SiCl4,SiCl4分子中硅原子最外层有4个电子,能形成4个共价键达到稳定结构,每个氯原子能形成一个共价键达到稳定结构;
(2)根据碳和氧化铝的化学性质的差异进行分离,氧化铝为两性氧化物;
(3)根据图示ZrCl4与水反应产物为ZrOCl2•8H2O,结合原子守恒进行解答;
(4)合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质,合金的硬度大,熔点低,陶瓷属于无机非金属材料,二氧化锆为化合物无丁达尔效应,氦为稀有气体,能作保护气;
(5)电解K2ZrF6与KCl等组成的熔体,反应物为K2ZrF6、KCl,生成物为金属锆,锆的化合价降低,则氯的化合价升高生成氯气,根据原子守恒即得失电子守恒解答;
(6)燃料所在极为负极,负极失去电子发生氧化反应,为乙烯失电子和氧离子反应生成二氧化碳和水.
解答 解:锆英石(主要成分为ZrSiO4,也可表示为ZrO2•SiO2,还含少量Al2O3、SiO2、Fe2O3等杂质),通入足量的氯气以及和足量的石焦油反应,ZrSiO4转化为ZrCl4,加水水解,使ZrCl4转化为ZrOCl2•8H2O,900℃加热分解,即可得到ZrO2,加入镁置换得到海绵锆,加入镁置换得到海绵锆.
(1)根据在化合物中正负化合价代数和为零,氧元素显-2价,硅元素显+4价,设锆元素(Zr)的化合价是x,可知ZrSiO4中锆元素(Zr)的化合价:x+(+4)+(-2)×4=0,则x=+4,锆英石(主要成分为ZrSiO4,也可表示为ZrO2•SiO2,还含少量Al2O3、SiO2、Fe2O3等杂质),杂质SiO2也能在高温气化条件下反应生成SiCl4,则分馏后得到的SiCl4质量通常比由纯ZrSiO4发生的反应得到的SiCl4质量大,SiCl4分子中硅原子最外层有4个电子,能形成4个共价键达到稳定结构,每个氯原子能形成一个共价键达到稳定结构,电子式为: ,
,
故答案为:+4;因为杂质中的SiO2也通过反应产生了SiCl4; ;
;
(2)氧化铝为两性氧化物,易溶于强酸强碱,碳不溶于非氧化性酸,不溶于碱,从滤渣中分离出C和A12O3两种固体:加碱浸取过滤得到C,再向滤液中通入足量CO2,过滤后将固体加热得到氧化铝.(或加酸浸取过滤得到C,再向滤液中加氨水,过滤后将固体加热得到氧化铝),
故答案为:加碱浸取过滤得到C,再向滤液中通入足量CO2,过滤后将固体加热得到氧化铝.(或加酸浸取过滤得到C,再向滤液中加氨水,过滤后将固体加热得到氧化铝);
(3)ZrCl4与水反应产物为ZrOCl2•8H2O,根据原子守恒,反应方程式为:ZrCl4+9H2O═ZrOCl2•8H2O+2HCl,
故答案为:ZrCl4+9H2O═ZrOCl2•8H2O+2HCl;
(4)a.合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的混合物.一般说来合金的硬度一般比各成分金属大,多数合金的熔点 低于组成它的成分金属的熔点,所以锆合金比纯锆的熔点低,硬度大,故a错误;
b.陶瓷属于无机非金属材料,二氧化锆陶瓷属于新型无机非金属材料,故b正确;
c.将一束光线通过胶体会产生一条光亮的通路,但二氧化锆为化合物无丁达尔效应,故c错误;
d.氦为稀有气体,可采用氦作反应堆包裹核燃料的锆合金的冷却剂,故d正确;
故答案为:bd;
(5)电解K2ZrF6与KCl等组成的熔体,反应物为K2ZrF6、KCl,生成物为金属锆,锆的化合价降低(+4→0),则氯的化合价升高生成氯气(-1→0),转移4e-,根据原子守恒即得失电子守恒所以方程式为:K2ZrF6+4KCl$\frac{\underline{\;电解\;}}{\;}$Zr+6KF+2Cl2↑,
故答案为:K2ZrF6+4KCl$\frac{\underline{\;电解\;}}{\;}$Zr+6KF+2Cl2↑;
(6)该燃料电池中通入乙烯的一极为负极,发生氧化反应,乙烯失电子和氧离子反应生成二氧化碳和水,电极反应式为:C2H4+6O2--12e-═2CO2+2H2O,
故答案为:C2H4+6O2--12e-═2CO2+2H2O.
点评 本题考查了海绵锆的制备以及物质分离提纯的方法和流程分析应用,涉及流程的分析应用、离子方程式的书写、基本实验操作、电解原理等,侧重于学生的分析能力和实验能力的考查,解答该类题目,注意把握实验原理和操作流程的目的,主要是物质性质的理解,题目难度中等.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液与K+、NO3-、OH-可以大量共存 | |
| B. | 该溶液显碱性的原因为ClO-+H2O?HClO+OH- | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3 BaSO4↓+2Al(OH)3↓ | |
| B. | 将少量CO2通入NaClO溶液中:ClO-+CO2+H2O═HCO3-+HClO (已知:次氯酸的Ka为2.95×10-8,碳酸的Ka2为5.6×10-11) | |
| C. | 次氯酸钙溶液中通入足量SO2:Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+ | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
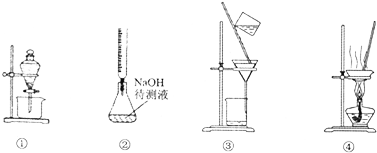
| A. | 图①表示分离CCl4和水的混合溶液的装置 | |
| B. | 图②表示已知浓度的盐酸溶液滴定未知浓度的氢氧化钠溶液的装置 | |
| C. | 图③表示分离二氧化锰和氯化锰溶液的装置 | |
| D. | 图④表示蒸干氯化铝溶液制AlCl3的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
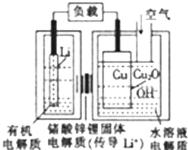 某锂电池的结构如图所示,该电池放电过程中的一个电极反应式为Cu2O+2e-+H2O=2Cu+2OH-,下列说法正确的是( )
某锂电池的结构如图所示,该电池放电过程中的一个电极反应式为Cu2O+2e-+H2O=2Cu+2OH-,下列说法正确的是( )| A. | 放电时,Li+透过固体电解质向Li极移动 | |
| B. | 放电时,负极的电极反应式为Li-e-+OH-=LiOH | |
| C. | 放电时,水溶液的pH不断升高 | |
| D. | 放电过程中需要不断地补充Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
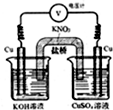 实验室利用如图所示装置.通过测电压求算Cu(OH)2的沉淀溶解平衡常数,工作一段时间后,两电极质量均增大.下列说法不正确的是( )
实验室利用如图所示装置.通过测电压求算Cu(OH)2的沉淀溶解平衡常数,工作一段时间后,两电极质量均增大.下列说法不正确的是( )| A. | 该装置工作时化学能转化为电能 | B. | 左池中的铜电极作正极 | ||
| C. | 总反应为Cu2+(aq)+2OH-(aq)?Cu(OH)2(s) | D. | 盐桥中的K+移向CuSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com