
| A.加热 | B.不用稀硫酸,改用质量分数为98%的浓硫酸 |
| C.不用铁片,改用镁条 | D.不用铁片,改用铁粉 |
科目:高中化学 来源:不详 题型:单选题
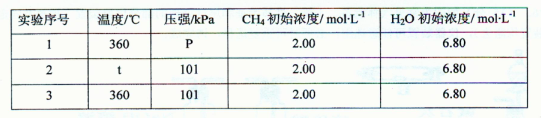
 CO(g)+3H2(g);△H=+206.lkJ·mol-l。
CO(g)+3H2(g);△H=+206.lkJ·mol-l。
| A.v(正)>v(逆) | B.v(正)<v(逆) |
| C.v(正)=v(逆) | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
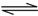 2NH3(g)的△H= 。
2NH3(g)的△H= 。 积分数为 。
积分数为 。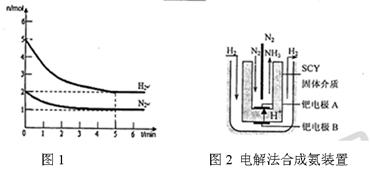
 内外
内外 表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A
表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A 上发生的电极反应式是 。
上发生的电极反应式是 。 查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 C(g),2 min时反应达到平衡状态(温度不变),剩余1.8 mol B,并测得C的浓度为0.4 mol·L-1。请填写下列空白:
C(g),2 min时反应达到平衡状态(温度不变),剩余1.8 mol B,并测得C的浓度为0.4 mol·L-1。请填写下列空白:
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a>b | B.a<b | C.a="b" | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
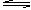 pC(g)+qD(g);ΔH<0。下列结论中正确的是( )
pC(g)+qD(g);ΔH<0。下列结论中正确的是( ) 增大1倍,此时A的浓度变为原来的0.48 倍,则m+n>p+q
增大1倍,此时A的浓度变为原来的0.48 倍,则m+n>p+q 平衡时,A.B的转化率相等,说明反应开始A.B的物质的量之比为m∶n
平衡时,A.B的转化率相等,说明反应开始A.B的物质的量之比为m∶n查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(气)+D(气),以下能说明已达平衡状态的是
C(气)+D(气),以下能说明已达平衡状态的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com