
| ||
| △t |
| n |
| V |
| 转化量 |
| 起始量 |
| ||
| △t |
| ||
| 2 |
| n |
| V |
| 1.2 |
| 3 |
| 0.3 |
| 1.5 |
| 8mol |
| 10mol |


科目:高中化学 来源: 题型:

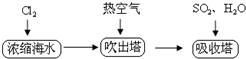
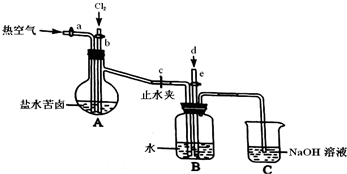

| 化学式 | Ca(OH)2 | CaSO4 | BaCO3 | BaSO4 | MgCO3 | Mg(OH)2 |
| Ksp | 1.0×10一4 | 7.1×10一5 | 8.1×10一9 | 1.08×10一10 | 3.5×10一5 | 1.6×10一11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2和SO2都能使石蕊试液和品红褪色 |
| B、实验室可用NaOH溶液处理NO2和HCl废气 |
| C、实验室可用浓硫酸干燥氨气 |
| D、Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,饱和Mg(OH)2溶液与饱和Co(OH)2溶液相比,前者的pH大 |
| B、25℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C、25℃时,Mg(OH)2固体在20mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小 |
| D、25℃时,在Co(OH)2的悬浊液加入MgCl2溶液后,Co(OH)2可能转化成为Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O |
| B、NaHCO3 |
| C、Na2CO3 |
| D、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2,+7 | B、2,+6 |
| C、4,+7 | D、4,+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁表面发生吸氧腐蚀时,钢铁表面水膜的pH增大 |
| B、在镀件上电镀锌,可以用锌作阳极,也可以用惰性电极材料作阳极 |
| C、电解精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量少 |
| D、工作时在原电池的负极和电解池的阳极上都是发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com