
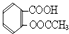
 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:

 .
.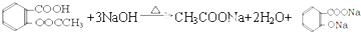 .
.分析 醋酸酐和水杨酸混合,然后向混合溶液中加入浓硫酸,摇匀后加热至85℃,然后冷却、过滤、水洗得到粗产品,然后向粗产品中加入饱和碳酸氢钠溶液,使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,从而除去杂质;然后加入浓盐酸除去剩余的碳酸氢钠、将乙酰水杨酸钠转化为乙酰水杨酸,最后过滤、洗涤、干燥得到乙酰水杨酸.
(1)控制温度85℃,应采取水浴加热;
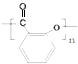
(2)水杨酸含有羧基和羟基,可以发生缩聚反应;
(3)①饱和NaHCO3可以使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离;
②强酸可以制取弱酸,生成乙酰水杨酸,乙酰水杨酸微溶于水;
③水杨酸中含有酚羟基,遇FeCl3溶液发生显色反应;
(4)①羧基能与氢氧化钠反应,水解得到的酚羟基、乙酸与去氧化钠反应;
②计算乙酰水杨酸消耗的氢氧化钠的物质的量,结合乙酰水杨酸的物质的量是消耗的氢氧化钠的物质的量的$\frac{1}{3}$,可以得到阿司匹林药片中乙酰水杨酸质量分数.
解答 解:醋酸酐和水杨酸混合,然后向混合溶液中加入浓硫酸,摇匀后加热至85℃,然后冷却、过滤、水洗得到粗产品,然后向粗产品中加入饱和碳酸氢钠溶液,使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,从而除去杂质;然后加入浓盐酸除去剩余的碳酸氢钠、将乙酰水杨酸钠转化为乙酰水杨酸,最后过滤、洗涤、干燥得到乙酰水杨酸.
(1)控制温度85℃,温度低于100℃,应采取水浴加热,受热均匀,便于控制温度,
故答案为:水浴加热;
(2)水杨酸含有羧基和羟基,可以发生缩聚反应生成高聚物,得到高聚物为: ,
,
故答案为: ;
;
(3)①用少量饱和NaHCO3溶解粗产品,目的是使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离,
故答案为:使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离;
②滤液缓慢加入浓盐酸中,生成乙酰水杨酸,乙酰水杨酸微溶于水,所以会有浑浊产生,
故答案为:有浑浊产生;
③酚羟基能和氯化铁发生显色反应,检验最终产品中是否含有水杨酸的化学方法是:取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫色则含水杨酸,
故答案为:取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫色则含水杨酸;
(4)①羧基能与氢氧化钠反应,水解得到的酚羟基、乙酸与去氧化钠反应,反应方程式为: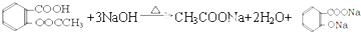 ,
,
故答案为: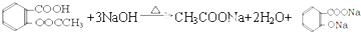 ;
;
②乙酰水杨酸消耗的氢氧化钠的物质的量为:aV1×10-3-bV2×10-3,乙酰水杨酸的物质的量是消耗的氢氧化钠的物质的量的$\frac{1}{3}$,阿司匹林药片中乙酰水杨酸质量分数的表达式为$\frac{0.180(a{V}_{1}-b{V}_{2})}{3m}$,
故答案为:$\frac{0.180(a{V}_{1}-b{V}_{2})}{3m}$.
点评 本题考查有机物的制备与合成,关键是明确实验原理与官能团的性质,注意对题目信息的应用,掌握物质分离提纯常用方法,较好的考查学生分析能力与知识迁移应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 | |
| B. | 滴定达到终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 | |
| D. | 随着NaOH溶液的滴入,锥形瓶中的pH由小变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| B. | SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱 | |
| C. | 根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液 | |
| D. | 焰火的五彩缤纷是某些金属元素的性质的表现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
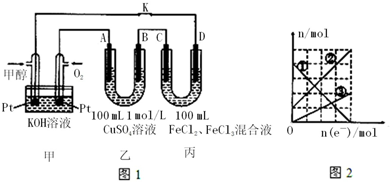
| A. | 负极的电极反应式是:CH3OH-6e-+8OH-═CO32-+6H2O | |
| B. | 乙中A极析出的气体在标准状况下的体积为1.12 L | |
| C. | 右图中②线表示的是Fe2+离子的变化 | |
| D. | 反应结束后,要使丙装置溶液中金属阳离子恰好完全沉淀,需要280 mL 5.0 mol/L NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  干燥Cl2 | |
| B. |  配制100 mL 0.1 mol•L-1 硫酸溶液 | |
| C. |  分离沸点相差较大的互溶液体混合物 | |
| D. |  分离互不相溶的两种液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | CH3CH2OH | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物CH3CH(C2H5)CH(C2H5)CH(CH3)2的名称是2-甲基-3,4-二乙基戊烷 | |
| B. | 蔗糖、纤维素的水解过程都是高分子转化为小分子的过程 | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也不存在同分异构体 | |
| D. | HOCH2COOH既可以发生取代反应又可以发生缩聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com