
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____;砷酸的第一步电离方程式为______。
(2)“一级沉砷”中FeSO4的作用是_____;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______。
(3)沉淀X为____(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______。
【答案】+3 H3AsO4![]() H++H2AsO4- 除去过量的硫离子,As2S3+3S2-
H++H2AsO4- 除去过量的硫离子,As2S3+3S2-![]() 2AsS32-使平衡逆向进行,提高沉砷效果 H2AsO3+H2O2=H3AsO4+H2O CaSO4
2AsS32-使平衡逆向进行,提高沉砷效果 H2AsO3+H2O2=H3AsO4+H2O CaSO4 ![]()
【解析】
废水中砷元素主要以亚砷酸(H3AsO3)形式存在,加入硫化钠、硫酸亚铁除去过量的硫离子,过滤得到As2S3和FeS,滤液中加入过氧化氢和氧化钙,H2 O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸,过滤得到砷酸铁、砷酸钙、氢氧化铁、沉淀硫酸钙等;
(1)根据化合物中化合价代数和为0计算;砷酸为弱酸,分步电离;
(2)As2 S3与过量的S2-反应,As2S3(s)+3S2-(aq)2AsS33-(aq),根据化学平衡移动分析FeSO4的作用;由流程可知:“二级沉砷”中H2O2与H3AsO3反应生成H3AsO4;
(3)流程分析可知钙离子结合硫酸根离子形成硫酸钙沉淀;
(4)AsH3和氨气分子结构相同为共价化合物,砷原子和三个氢原子形成三个As-H键。
(1)亚砷酸(H3AsO3)中氢元素+1价,氧元素-2价,化合物化合价代数和为0,则砷元素的化合价为+3价;第ⅤA族非金属元素形成最高价含氧酸中磷、砷形成的含氧酸都是弱酸,水溶液中分步电离,电离方程式为:H3AsO4![]() H++H2AsO4-;
H++H2AsO4-;
(2)废水中砷元素主要以亚砷酸(H3AsO3)形式存在,加入硫化钠、硫酸亚铁除去过量的硫离子,过滤得到As2S3和FeS,滤液中加入过氧化氢和氧化钙,H2 O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸,过滤得到砷酸铁、砷酸钙、氢氧化铁、沉淀硫酸钙等;
“一级沉砷”中FeSO4的作用是除去过量的硫离子,As2S3+3S2-![]() 2AsS32-使平衡逆向进行,提高沉砷效果,亚铁离子与过量的S2-结合生成FeS沉淀,防止AS2O3与S2-结合生成AsS33-;“二级沉砷”中H2 O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸,反应的化学方程式为:H2AsO3+H2O2=H3AsO4+H2O;
2AsS32-使平衡逆向进行,提高沉砷效果,亚铁离子与过量的S2-结合生成FeS沉淀,防止AS2O3与S2-结合生成AsS33-;“二级沉砷”中H2 O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸,反应的化学方程式为:H2AsO3+H2O2=H3AsO4+H2O;
(3)流程分析可知,加入氧化钙和水反应生成氢氧化钙,氢氧化钙和砷酸反应生成砷酸钙沉淀、和铁离子反应生成氢氧化铁沉淀,钙离子结合硫酸根离子形成硫酸钙沉淀,所以沉淀X为CaSO4;
(4)AsH3和氨气分子结构相似,都属于共价化合物,砷原子和三个氢原子形成三个As-H键,其电子式为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如图所示。下列说法不正确的是( )

A.a电极反应式是![]()
B.消耗标准状况下![]() 时,被消除的NO2的物质的量为
时,被消除的NO2的物质的量为![]()
C.若离子交换膜是阳离子交换摸,装置右室中溶液的碱性增强
D.整个装置中NaOH的物质的量不断减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】艾司洛尔(I)是预防和治疗手术期心动过速的一种药物,某合成路线如图,回答下列问题:

(1)A的化学名称为___,D中所含官能团的名称为____。
(2)G→H的反应类型为___,H→I的反应类型为___。
(3)C→D中步骤①的化学反应方程式为____。
(4)X是F的同分异构体,若同时满足下列条件中的①②④,则X有___种同分异构体;若同时满足下列条件中的①②⑤,则X有____种同分异构体;若同时满足下列条件中的①②③,请写出X的结构简式___。
①与碳酸氢钠溶液反应生成二氧化碳②与FeCl3溶液发生显色反应③核磁共振氢谱有四组峰且峰面积之比为6:2:1:1④苯环上只有两个取代基⑤苯环上只有三个取代基
(5)参照上述合成路线,设计以![]() 和
和 为主要原料制备
为主要原料制备 的合成路线。___
的合成路线。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分)用辉铜矿(主要成分为 Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下:

(1)下列措施是为了加快浸取速率,其中无法达到目的的是____(填字母)。
A.延长浸取时间 | B.将辉铜矿粉碎 |
C.充分搅拌 | D.适当增加硫酸浓度 |
(2)滤渣I巾的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A可以是_______(填化学式);“赶氨”时,最适宜的操作方法是________。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.“神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
B.“加碘食盐”“含氟牙膏”“富硒营养品”“高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C.下图是反应物和生成物的能量变化示意图,则其可能发生的反应的热化学方程式可表示为:2A(g)+B(g)=2C(g);△H=QkJ/mol(Q>0)

D.已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) AH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )
CH3OH(g) AH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )

A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c), v(b)>v(d)
C. 平衡常数:K(a)>K(c),K(b)=K(d)
D. 平均摩尔质量:M(a)<M(c),M(b)<M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 分子式为C2H6O的有机化合物性质相同
B. 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能途径a:![]() ,途径b:
,途径b:![]()
C. 在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数
D. 通过化学变化可以直接将水转变为汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常做引发剂;e、f为常见气体单质。下列有关说法正确的是( )

A. 简单离子的半径:Y>Z>X
B. 简单氢化物的沸点:Y>X
C. 最高价氧化物对应水化物的碱性:Z> Y
D. Y、Z的氧化物所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在其他条件不变时,改变某一条件对aA(g)+bB(g)![]() cC(g)化学平衡的影响,得到如图所示图像(α表示平衡转化率),回答下列问题:
cC(g)化学平衡的影响,得到如图所示图像(α表示平衡转化率),回答下列问题:
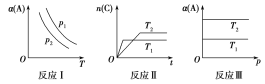
(1)在反应Ⅰ中,若p1>p2,则此正反应为___(填“吸热”或“放热”)反应,也是一个气体分子数____(填“减小”或“增大”)的反应,由此判断,此反应自发进行必须满足的条件是___。
(2)在反应Ⅱ中,T1______T2(填“>”“<”或“=”),该正反应为______(填“吸热”或“放热”)反应。
(3)在反应Ⅲ中,若T1>T2,则该正反应能否自发进行?_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com