
����β����NOx�����������������������㷺��ע��
��1��ij��ȤС����������������Ϣ��
N2(g)+ O2(g)= 2NO(g) ��H= + 180.5 kJ/mol
2H2(g)+ O2(g)= 2H2O(g) ��H= - 483.6 kJ/mol
��Ӧ2H2(g)+ 2NO(g) = 2H2O(g) + N2(g) ��H=________��
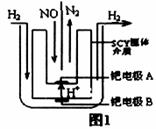 ��2����С�����õ��ԭ���������ͼ1װ�ý���H2��ԭNO��ʵ��[�����ӵ����Ե�SCY�մ�(�ܴ���H+)Ϊ���ʣ������ٱ�Ĥ���缫]���ٵ缫AΪ____�����缫��ӦʽΪ_______________��
��2����С�����õ��ԭ���������ͼ1װ�ý���H2��ԭNO��ʵ��[�����ӵ����Ե�SCY�մ�(�ܴ���H+)Ϊ���ʣ������ٱ�Ĥ���缫]���ٵ缫AΪ____�����缫��ӦʽΪ_______________��
��3����Ⱦ��NO��NO2Ҳ�������ռ���Һ���գ��������������壬�÷�Ӧ�����ӷ���ʽΪ______________________________________________��ֻ��NO2Ҳ����NaOH��Һ��Ӧ������NaNO2 ��NaNO3 ������ij�ռ���Һ��ȫ����n mol NO2��m mol NO��ɵĻ�����壬��������Һ��c(NO3��)�� c(NO2��) = 1��9����ԭ���������NO2��NO�����ʵ���֮��n��m =_______________ ��
��4�������йغ���Ԫ����Һ��˵����ȷ����______________
A��c(NH4+)��ȵ�(NH4)2SO4��(NH4)2CO3��(NH4)2Fe(SO4)2��Һ�У�
c[(NH4)2Fe(SO4)2] �� c[(NH4)2SO4]��c[(NH4)2CO3]
B�������£��������pH=13��NaOH��Һ��pH=1��HNO2��Һ��ϣ�������Һ��
c(Na+)��c(NO2��)��c(OH��)��c(H+)
C��ij��Һ��ֻ����OH����H+��Cl����NH4+�������ӣ�������Ũ��c(NH4+)��c(Cl��)��c(OH��)��c(H+)������Һ��c(NH3��H2O) + c(NH4+)��c(Cl��)
D����NH4Cl��Һ�����Ʊ�NH4Cl����
E��ʩ��ʱ����ľ��(��Ч�ɷ�ΪK2CO3)������NH4Cl���ʹ�ã�����ΪK2CO3��NH4Cl��Ӧ���ɰ����ή�ͷ�Ч
F����ӦNH3(g)+HCl(g)=== NH4Cl(s)�������¿��Է����У���÷�Ӧ�ġ�H<0
��5�� NO2���ð�ˮ��������NH4NO3��25��ʱ����a mol NH4NO3����ˮ����Һ�����ԡ�ԭ����
�������ӷ���ʽ��ʾ���������Һ�μӰ�ˮ����Һb Lʱ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫ ������������������ƶ���������Һ�а�ˮ��Ũ��Ϊ mol��L-1����NH3��H2O�ĵ���ƽ�ⳣ��ȡKb=2��10-5mol��L-1��
��6���ں����ܱ������У���������泥�NH2COONH4���ֽⷴӦ��
NH2COONH4��s��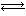 2NH3(g)+CO2(g)��
2NH3(g)+CO2(g)��
�� �����жϸ÷ֽⷴӦ�Ѿ��ﵽƽ����� ��
A��2v(NH3)=v(CO2) B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
�� ȡһ�����İ�������粒������һ�����������ܱ���������У���25.0���´ﵽ�ֽ�ƽ�⡣���ں�����ѹ�������������������粒���������� (���������С�����䡱����ƽ�ⳣ��_________(���������С�����䡱����
 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ԭ�ӵ�������a g��12Cԭ�ӵ�������b g����NA��ʾ�����ӵ�����������˵������ȷ����(����)
����Ԫ�ص����ԭ������һ����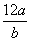 ����m g����ԭ�ӵ����ʵ���һ����
����m g����ԭ�ӵ����ʵ���һ����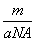 mol���۸���ԭ�ӵ�Ħ��������aNA g/mol����a g����ԭ��������������17 mol
mol���۸���ԭ�ӵ�Ħ��������aNA g/mol����a g����ԭ��������������17 mol
A���٢� B���ڢ�
C���٢� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪25 ��ʱ�й�����ĵ���ƽ�ⳣ�����±���
| ���ữѧʽ | HX | HY | H2CO3 |
| ����ƽ�ⳣ�� | 7.8��10��9 | 3.7��10��15 | K1��4.3��10��7 K2��5.6��10��11 |
�����ƶ���ȷ����(����)
A��HX��HY������������ԣ�HX>HY
B����ͬ��������Һ�ļ��ԣ�NaX>Na2CO3>NaY>NaHCO3
C�����H����������CO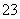 >Y��>X��>HCO
>Y��>X��>HCO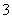
D��HX��HY������ͬ������H2CO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Fe3����AgFe2����Ag��������Fe3������ʴҺ���Թ��е�����ϴȥ��
(1)FeCl3��Һ�����ԣ�ԭ����________(�����ӷ���ʽ��ʾ)��
(2)����FeCl3��Һϴ��������������ȷ����________(��ѡ����ĸ)��
a����Ԫ��������С������ b��c(Fe3��)��С
c��c(Cl��)����
(3)��Fe(NO3)3��Һϴ����ijͬѧ����ϴ����Һ(��Fe3����Fe2����Ag����NO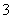 )�л����������������·�ߣ�
)�л����������������·�ߣ�
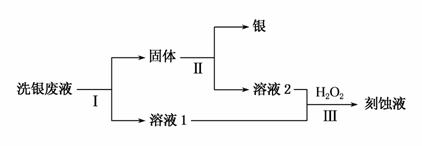
�ٹ��̢��з�Ӧ�����ӷ���ʽ��__________________________��
�ڹ��̢��м�����Լ�������_____________________��
�۹��̢��з�����Ӧ�����ӷ���ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����(����)
A������ģ�� �����Ա�ʾ������̼���ӣ�Ҳ���Ա�ʾˮ����
�����Ա�ʾ������̼���ӣ�Ҳ���Ա�ʾˮ����
B�������£���0��4mol/L HA��Һ��0��2mol/LNaOH��Һ�������ϣ����Ի��ʱ��Һ����ı仯����û����Һ��pH=5��������Һ����ˮ�������c(H+) =1��10-5 mol/L
C����̼�²��ϡ�̼������ĭ����ÿ����ĭ����Լ4000��̼ԭ�ӣ�ֱ��Լ6��9nm���ڵ���-183��ʱ����ĭ�������ô��ԣ���̼������ĭ����ʯī��Ϊͬλ��
D����֪ Ag2CrO4��KspΪ1.12��10��12���������1��10��4 mol��L��1��AgNO3��Һ��
1��10��4 mol��L��1��K2Cr04��Һ��ϣ�������Ag2CrO4��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й����Ȼ�ѧ��Ӧ����������ȷ���ǣ� ��
A��HCl��NaOH��Ӧ���к��ȡ�H����57.3kJ/mol����H2SO4��Ca(OH)2��Ӧ���к���
��H��2��(��57.3)kJ/mol
B��CO(g)��ȼ������283.0kJ/mol����2CO2(g)===2CO(g)��O2(g)��Ӧ��
��H��+2��283.0kJ/mol
C����H>0����S>0�����κ��¶��¶������Է����С�
D��1mol����ȼ��������̬ˮ�Ͷ�����̼���ų��������Ǽ����ȼ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ܱ������������з�ӦaA(g)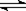 cC(g)��dD(g)����Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬���ٴδﵽƽ��ʱ��D��Ũ��Ϊԭƽ���1.8��������������ȷ���ǣ� ��
cC(g)��dD(g)����Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬���ٴδﵽƽ��ʱ��D��Ũ��Ϊԭƽ���1.8��������������ȷ���ǣ� ��
A��A��ת���ʱ�� B��ƽ��������Ӧ�����ƶ�
C��D������������ D��a �� c��d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����P(s)��Cl2(g)������Ӧ����PCl3(g)��PCl5(g)����Ӧ���̺�������ϵ��ͼ��ʾ����ͼ�еġ�H��ʾ����1mol��������ݣ���
��1��P��Cl2��Ӧ����PCl3���Ȼ�ѧ����ʽ_____________________________________��
��2��PCl5�ֽ��PCl3��Cl2���Ȼ�ѧ����ʽ______________________________________��
��3��P��Cl2��������Ӧ����1molPCl5��
��H3��_________��P��Cl2һ����Ӧ����1molPCl5�ġ�H4__________��H3 (����ڡ�����С�ڡ����ڡ�)��
��4��PCl5������ˮ��ַ�Ӧ���������������ᣬ�仯ѧ����ʽ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й������仯��������ӷ���ʽһ���������(����)
A����������������ᷴӦ��Fe(OH)3��3H��===Fe3����3H2O
B������ϡ���ᷴӦ��Fe��4H����NO ===Fe3����NO����2H2O
===Fe3����NO����2H2O
C��������������Ũ���ᷴӦ��Fe3O4��8H��===Fe2����2Fe3����4H2O
D���廯������Һ����ˮ��Ӧ��2Fe2����4Br����3Cl2===2Fe3����2Br2��6Cl��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com