
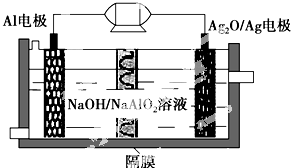
 Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )
Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )| A. | 工作时正极发生还原反应 | |
| B. | 当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol | |
| C. | Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O | |
| D. | 工作时电解液中的Na+透过隔膜移向Al电极放电充电 |
分析 由原电池总反应可知,原电池工作时Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,Ag2O被还原,应为原电池的正极,电极反应式为Ag2O+2e-+H2O=2Ag+2OH-,结合电极反应式进行判断.
解答 解:A.原电池工作时,正极发生还原反应,该反应中氧化银被还原为银,故A正确;
B.Ag2O中Ag的化合价为+1价,当电极上析出1.08 gAg即0.01mol时,电路中转移的电子为0.01mol,故B正确;
C.原电池工作时Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,故C正确;
D.铝为负极,原电池工作时阳离子向正极移动,故D错误.
故选D.
点评 本题考查化学电源新型电池,为高考常见题型,侧重于学生的分析能力和计算能力的考查,题目难度中等,解答本题的关键是能正确书写电极方程式,做题时注意体会书写方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
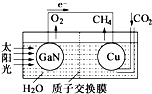 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | GaN表面发生氧化反应,有O2产生 | |
| C. | 电解液中的H+从质子交换膜右侧向左侧迁移 | |
| D. | Cu表面的电极反应式 CO2+8e-+8H+═CH4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
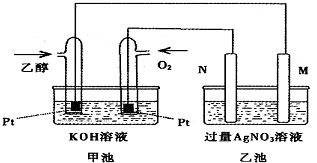 甲乙两池均是电化学装置,按下图连接.乙池中的两个电极分别是石墨电极和铁电极,已知工作过程M、N两个电极的质量均不减少,则下列说法正确的是( )
甲乙两池均是电化学装置,按下图连接.乙池中的两个电极分别是石墨电极和铁电极,已知工作过程M、N两个电极的质量均不减少,则下列说法正确的是( )| A. | M电极的材料是石墨 | |
| B. | 若乙池中某一电极质量增加4.32g时,理论上甲池消耗氧气为224mL | |
| C. | 在此过程中,甲池中OH-向通乙醇的一极移动 | |
| D. | 在此过程中,乙池溶液中电子从M电极向N电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
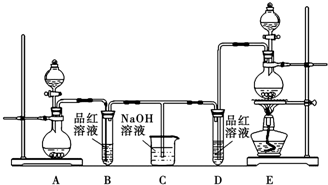
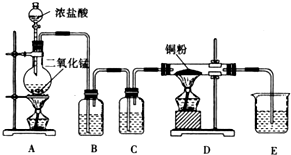 某实验学习小组用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.
某实验学习小组用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
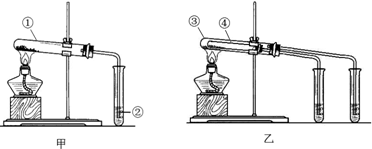
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com