
【题目】结合元素周期表,完成下列问题。
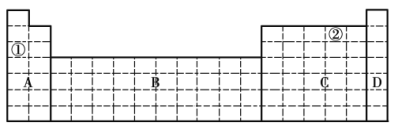
(1)在元素周期表中全部是金属元素的区域为______(填序号)。
a. A b. B c. C d. D
(2)有人认为形成化合物最多的元素不是第IVA族的碳元素,而是另一种短周期元素,请根据学过的化学知识判断这一元素是______(填元素符号)。
(3)①和②元素形成的两种常见化合物的化学式分别为______、______,它们都是______(填“共价化合物”或“离子化合物”)。
(4)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外M层与K层上的电子数相等。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置______。
②甲、乙两元素中,金属性较强的是______(填元素名称),可以验证该结论的实验有______(填序号)。
a. 将在空气中放置已久的这两种元素的块状单质分别放入热水中
b. 将这两种元素的单质粉末分别和相同浓度的盐酸反应
c. 将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d. 比较这两种元素的气态氢化物的稳定性
【答案】b H ![]()
![]() 离子化合物
离子化合物  镁 be
镁 be
【解析】
(1)A区为金属元素、非金属元素共同存在的区域;B区元素为过渡元素,全部为金属元素;C区为金属元素、非金属元素共同存在的区域;D区元素为零族元素(或稀有气体元素),故选:b;
(2)碳、氢两元素均可形成无机物、有机物,且碳、氢是形成有机物的主要元素,但是在无机物中,碳形成的化合物没有氢形成的化合物多,故答案为:H;
(3)①和②元素分别是Na元素,O元素,形成的化合物分别是![]() ,
,![]() ,均属于离子化合物,故答案为:
,均属于离子化合物,故答案为:![]() ;
;![]() ;离子化合物;
;离子化合物;
(4) ①根据题意可知,甲为A1元素,乙为Mg元素,填写在元素周期表中对应的位置如下图:
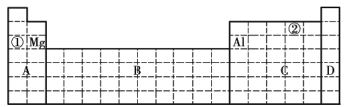
②根据题意可知,甲为A1元素,乙为Mg元素;同周期元素随原子序数的递增,金属性逐渐减弱,故Mg的金属性较强,验证该结论的依据是金属性较强的元素的单质更容易与![]() 或酸反应放出
或酸反应放出![]() ,故选:bc。
,故选:bc。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对于下列实验事实的解释,不合理的是
选项 | 实验事实 | 解释 |
A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
B | 电解CuCl2溶液阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
D | 钠与水反应剧烈;钠与乙醇反应平缓 | 羟基中氢的活泼性:H2O> C2H5OH |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
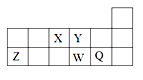
A. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B. 元素W的最高价氧化物对应水化物的酸性比Q的强
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述正确的是( )

A. 常温下,Z的单质为气态物质
B. Y、Z的阴离子的电子层结构都与R原子的相同
C. W的氢化物的稳定性要比X的强
D. Y的元素的非金属性比W元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
2、各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是_____,则下列判断正确的是(__________)
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:

(1)装置A中盛放的试剂是_______(填选项),化学反应方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数大于4的主族元素Xm+、Yn-的离子核外电子层结构相同,则关于X、Y两元素的叙述正确的是
A. X的原子序数小于Y的原子序数 B. X、Y的核电荷数之差是(m-n)
C. X和Y处于同一周期 D. Y元素与X元素的族序数之差是8-(m+n)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H14O4的有机物在酸性条件下水解生成一种酸和一种醇,且酸和醇的物质的量之比为1:2,则符合该条件的有机物有( )(不考虑立体异构)
A.8种B.10种C.13种D.16种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雕白块(NaHSO2·HCHO·2H2O,易溶于水,呈白色块状固体或结晶性粉状)可用作印染工业的还原剂、橡胶合成及制糖工业中的漂白剂。以SO2、纯碱、Zn及甲醛为原料生产雕白块及氧化锌的工艺流程如下:
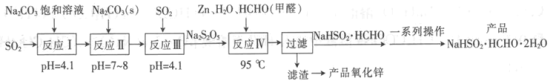
回答下列问题:
(1)NaHSO2·HCHO·2H2O中S元素的化合价为__________。
(2)“反应I”中得到的产物是__________(填化学式)。
(3)设计“反应II”,“反应III”中继续通入SO2的目的是_________。
(4)“反应Ⅳ”的化学方程式为______________。
(5)“过滤”后,“滤渣”是__________(填化学式)。
(6)“一系列操作”包括蒸发浓缩________、________、________干燥。
(7)一种测定雕白块中硫的质量分数的方法如下:称取a g产品溶于适量水中,加入稍过量的碘水(反应生成NaHSO4和HCOOH),充分反应后加入足量BaCl2溶液,过滤,滤渣经干燥后称得质量为b g。
①雕白块与碘水反应的化学方程式为___________。
②产品中硫的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
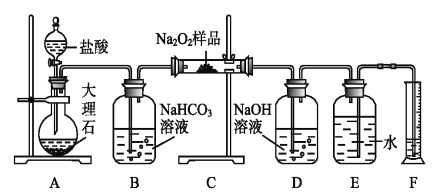
①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com