
 有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
有原子序数依次增大的4种短周期元素X、Y、Z、W,已知: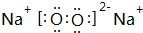 ,含有离子键、共价键,
,含有离子键、共价键, ;离子键、共价键;
;离子键、共价键;

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 大气中硫、氮的氧化物是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等.某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成3份,进行如下实验:
大气中硫、氮的氧化物是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等.某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成3份,进行如下实验:| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀,产生的气体(N)关系如图 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 4 |
| H | + 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0L 0.1 mol?L-1Na2S溶液中含有的S2-离子数小于0.1NA |
| B、1 mol氯气与过量的Fe反应,转移电子的数目为2 NA |
| C、2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
| D、50mL18.4mol?L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、c(CH3COOH)+c(CH3COO-)=0.1 mol/L |
| C、c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为Zn-Cu原电池的示意图,请回答:
如图为Zn-Cu原电池的示意图,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com