
| A、11gT2O含有的中子数为6NA |
| B、1molNa2O2与CO2完全反应转移的电子数为2NA |
| C、常温下,0.2L0.5mol/LNH4NO3溶液的氮原子数小于0.2NA |
| D、标准状况下,2.24LH2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |
| m |
| M |
| 11g |
| 22g/mol |
| 2.24L |
| 22.4L/mol |


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
A、二氧化碳的电子式: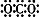 | ||
B、S2-的粒子结构示意图: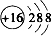 | ||
C、甲烷分子的结构式: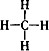 | ||
D、R2+离子核外有a个电子,b个中子,R原子克表示为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B和C可能都是气体 |
| B、B和C一定都是气体 |
| C、若C为固体,则B一定是气体 |
| D、不可能B为固体,C为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一样多 |
| B、前者大于后者 |
| C、后者大于前者 |
| D、数据不完整,无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所用NaOH已经潮解 |
| B、容量瓶中原有少量蒸馏水 |
| C、加水定容时俯视刻度线 |
| D、用带游码的托盘天平称2.4g NaOH时误用了“左码右物”方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中导电粒子的数目减少 | ||
B、溶液中
| ||
| C、醋酸的电离程度变大,c(H+)也增大 | ||
D、溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同一周期元素的原子,半径越小越容易失去电子 |
| B、ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C、向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱 |
| D、主族元素的最高正化合价等于该元素原子的核外电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | |
| Z | W |
| A、原子半径:W>Z>Y>X |
| B、最高价氧化物对应水化物的酸性:Z>W>X |
| C、Z和W的氢化物中,W的氢化物最稳定 |
| D、X的最高价氧化物对应的水化物能与其气态氢化物发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com