
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ② |
 ;①在空气中燃烧后生成产物为Na2O2,由钠离子与过氧根离子构成,电子式为:
;①在空气中燃烧后生成产物为Na2O2,由钠离子与过氧根离子构成,电子式为: ,故答案为:
,故答案为: ;
; ;
; ,
, .
.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
 如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:
如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、安静状态下,长时间太快且太深的呼吸可以使呼出的气体中CO2的体积分数大于5% |
| B、人在痛苦中,长时间太深的呼吸可导致血液PH降低 |
| C、人在安静状态下,长时间太浅的呼吸可以导致血液PH降低 |
| D、窒息而死的人血液PH高于7.45 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
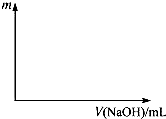 将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol?L-1的NaOH溶液.当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2=650mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750mL时,沉淀量不再改变.
将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol?L-1的NaOH溶液.当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2=650mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750mL时,沉淀量不再改变.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 燃烧热是指一定条件下1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.已知热化学方程式:①CO(g)+
燃烧热是指一定条件下1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.已知热化学方程式:①CO(g)+| 1 |
| 2 |
| 1 |
| 2 |
| A、由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2 kJ?mol-1 | ||
| B、H2的燃烧热为241.8 kJ?mol-1 | ||
| C、H2(g)转变成H2O(g)的化学反应一定要释放能量 | ||
D、根据②推知反应H2(g)+
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com