
����Ŀ��������dz����������������������ҩ���̻𣬹�ҵ����ʯ�����Ȼ����Ʊ�����ص���������
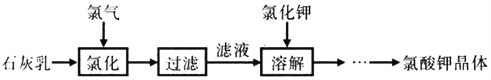
��֪���Ȼ�������Ҫ������Ӧ6Ca(OH)2+ 6Cl2![]() 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
����˵������ȷ����
A. ��ҵ���������ķ����ǵ�ⱥ��ʳ��ˮ
B. ���Ʊ����̿�֪��KClO3���ܽ�ȴ���Ca(ClO3)2���ܽ��
C. ���ȵ���Һ�м����Թ������Ȼ��أ��ܽ�������ȴ���д�������ؾ�������
D. �Ȼ�������Ҫ���ƽϸ��¶ȣ���Ŀ���Ǽӿ췴Ӧ���ʺͼ���Cl2��Ca(OH)2֮��ĸ���Ӧ
���𰸡�B
��������A. ��ҵ���������ķ����ǵ�ⱥ��ʳ��ˮ��A��ȷ��B. �ȵ���������Ȼ��ط�Ӧ�����ܽ�ȸ�С������أ�������Ʊ����̿�֪��KClO3���ܽ��С��Ca(ClO3)2���ܽ����B����C. ����KClO3���ܽ��С��Ca(ClO3)2���ܽ�ȣ��������ȵ���Һ�м����Թ������Ȼ��أ��ܽ�������ȴ���д�������ؾ���������C��ȷ��D. �Ȼ�������Ҫ���ƽϸ��¶ȣ���Ŀ���Ǽӿ췴Ӧ���ʺͼ���Cl2��Ca(OH)2֮��ĸ���Ӧ��D��ȷ����ѡB��


 Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ɫ��Һ��SO2���ã�������ɫ����ʵ����ͬ���ǣ� ��
��Ʒ����Һ��KMnO4������Һ����ˮ�ܵ��з�̪��NaOH��Һ�ݵ��۵���Һ
A.�٢�B.�٢ڢ�C.�ڢۢ�D.�ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����������Ϊ���������ں��º����ܱ������г���һ������NO��NH3����һ�������·�����Ӧ��6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)��
5N2(g) +6H2O(g)��
����˵���÷�Ӧ�Ѵﵽƽ��״̬�ı�־��_______
a����Ӧ����![]() ( NH3) =
( NH3) =![]() ( N2)
( N2)
b��������ѹǿ������ʱ��������仯
c��������N2�����ʵ�������������ʱ��������仯
d��������n(NO)��n(NH3)��n(N2)��n(H2O) = 6��4��5��6
��ij��ʵ���в��������NO��N2�����ʵ�����ʱ��仯��ͼ��ʾ��ͼ��b���Ӧ�����ʹ�ϵ��![]() (��)____
(��)____![]() (��)�����������������������d���Ӧ�����ʹ�ϵ��
(��)�����������������������d���Ӧ�����ʹ�ϵ��![]() (��)____
(��)____![]() (��)�����������
(��)�����������

��2��298 Kʱ������֪���ɱ�״����2.24 L NH3ʱ�ų�����Ϊ4.62 kJ��д���ϳɰ���Ӧ���Ȼ�ѧ����ʽ_______���ڸ��¶��£�ȡ1 mol N2��3 mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų���������С��92.4 kJ����ԭ����________��
��3��һ�������£���2 L�ܱ������ڣ���Ӧ2NO2(g)![]() N2O4(g) ��H����180 kJ��mol��1��n(NO2)��ʱ��仯���±���
N2O4(g) ��H����180 kJ��mol��1��n(NO2)��ʱ��仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
Ũ��mol/L | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
���ݱ��������ж�������pH=_________��
��2������β����NOx��CO�����ɣ�
����֪����������NO�ķ�ӦΪ��N2(g)+O2(g)![]() 2NO(g) ��H>0���£������ܱ������У�����˵������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����____
2NO(g) ��H>0���£������ܱ������У�����˵������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����____
A.���������ܶȲ��ٱ仯 B.��������ƽ�����������ٱ仯
C.N2��O2��NO�����ʵ���֮��Ϊ1��1��2 D.�����İٷֺ������ٱ仯
������ȼ�Ͳ���ȫȼ��ʱ����CO���������밴���з�Ӧ��ȥCO��2CO(g)=2C(s)+O2(g)����֪�÷�Ӧ�ġ�H��0����������ܷ�ʵ��______________����ܡ����ܡ���
��3��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
�ٽ�úת��Ϊ�������ȼ�ϡ���֪��
H2(g)+ 1/2O2(g) =H2O(g) ��H=��241.8kJ��mol-1
C(s)+1/2O2(g) =CO(g)��H =-110.5kJ��mol-1
д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ��___________________��
��ϴ�Ӻ�SO2��������
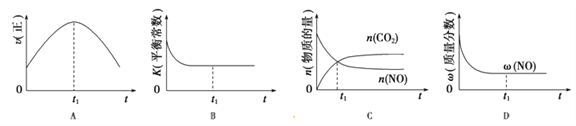
��4������β����������Ҫԭ����2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)����H��0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����_________������ţ�������ͼ��v����K��n��w�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ���������������
2CO2(g)+N2(g)����H��0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����_________������ţ�������ͼ��v����K��n��w�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ���������������
�����ŷŵĵ������úȼ�ղ����Ķ��������ǵ������������ġ�������ס�֮һ������̿�ɴ���������Ⱦ��NO����5L�ܱ������м���NO�ͻ���̿�����������ʣ���һ����������������E��F�����¶ȷֱ���T1���T2��ʱ����ø�����ƽ��ʱ���ʵ�����n/mol�����±���
���� �¶�/�� | ����̿ | NO | E | F |
��ʼ | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
��1��д��NO�����̿��Ӧ�Ļ�ѧ����ʽ______________________��
��2������������ӦT1��ʱ��ƽ�ⳣ��K1=__________________����T1��T2����÷�Ӧ�ġ�H__________________0(���������������������
��3��������ӦT1��ʱ�ﵽ��ѧƽ�����ͨ��0.1molNO���壬��ﵽ�»�ѧƽ��ʱNO��ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ������������Դ,һ����������CO��H2�ϳ�CH3OH:CO��g��+2H2 ��g��![]() CH3OH��g��H =a kJ��mol-1�������Ϊ2 L���ܱ������г���2mol CO��4mol H2����ò�ͬ�¶������������������ʵ�����ʱ����min���ı仯��ϵ������ͼ��������������ʾ��
CH3OH��g��H =a kJ��mol-1�������Ϊ2 L���ܱ������г���2mol CO��4mol H2����ò�ͬ�¶������������������ʵ�����ʱ����min���ı仯��ϵ������ͼ��������������ʾ��

��1�����жϷ�Ӧ�ﵽ��ѧƽ��״̬���� ������ĸ����
A��c��CO����c��H2���ı�ֵ���ֲ���
B������������ѹǿ���ֲ���
C�������������ܶȱ��ֲ���
D����λʱ������1molCO���ĵ�ͬʱ��1mol CH3OH����
E��v����H2����2 v����CH3OH��
��2���٢������ȣ���ı�ķ�Ӧ������ ��
�ڷ�Ӧ����9minʱ�ﵽƽ�⣬�ȽϷ�Ӧ����¶���T1���ͷ�Ӧ����¶���T3���ĸߵͣ�T1 T3���>����<����=������������Ӧ��________��Ӧ������Ȼ����ȡ�����
��3���ٷ�Ӧ����6 minʱ�ﵽƽ�⣬�ӷ�Ӧ��ʼ���ﵽƽ��ʱv ��CH3OH�� = mol/��L��min����
�ڷ�Ӧ����2 minʱ�ﵽƽ�⣬������¶��µ�ƽ�ⳣ��K= ����������¶Ȳ���������£���������Ӧ�ﵽƽ���ʱ�����������м���1 mol CO��3 mol CH3OH����ƽ�⽫��_________�������Ӧ���淴Ӧ�Ͳ��ƶ�������ԭ����______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com