
| A. | 120吨 | B. | 117.6吨 | C. | 116吨 | D. | 121吨 |
分析 FeS2在氧气充分灼烧,完全反应后生成Fe2O3,根据Fe元素守恒以及利用差量法计算FeS2的质量,进而计算FeS2的质量分数,据S元素守恒,利用关系式FeS2~2SO2~2SO3~2H2SO4计算.
解答 解:FeS2在氧气中充分灼烧,完全反应后生成Fe2O3,根据Fe元素守恒可得2FeS2~Fe2O3,利用差量法计算,设1.00g矿石样品中FeS2的质量为m,则:
2FeS2~Fe2O3 质量减少△m
240g 160g 80g
m 1g-0.76g=0.24g
m=$\frac{240g×0.24g}{80g}$=0.72g
所以该黄铁矿中FeS2的质量分数为$\frac{0.72g}{1g}$=72%,
据S元素守恒,可得反应的关系式为:FeS2~2SO2~2SO3~2H2SO4,
设制得98%的硫酸xt,
FeS2~2SO2~2SO3~2H2SO4
120g 196g
100t×(1-2%)×72% x×98%
x=$\frac{196g×100t×98%×72%}{120g×98%}$=117.6t,
故选:B.
点评 本题考查化学方程式的计算,题目难度中等,注意运用差量法和关系式法计算,侧重考查学生分析计算能力.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀盐酸 | Na2S | 漂粉精溶液 | 酸性:盐酸>氢硫酸>次氯酸 | |
| B | 浓盐酸 | KMnO4 | Na2S溶液 | 氧化性:KMnO4>Cl2>S | |
| C | 浓氨水 | NaOH | 酚酞 | 碱性:NaOH>NH3•H2O | |
| D | 浓硫酸 | Na2SO3 | BaCl2溶液 | SO2与可溶性钡盐均不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:X>Y>Z | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物稳定性:X<Y<Z | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3所含的分子数目为NA | |
| B. | 0.2molH2O2催化分解,转移电子数为0.2NA | |
| C. | 0.1mol/L的100mLH2SO3溶液中,含有的离子数约为0.03NA | |
| D. | 6.25 mL1 mol/L浓硫酸与足量铜反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
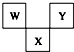 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )| A. | 三种元素的原子半径的大小顺序是W<Y<X | |
| B. | W最高价氧化物对应水化物具有强酸性,气态氢化物的水溶液具有弱碱性 | |
| C. | X元素的氧化物、氢化物的水溶液都呈酸性 | |
| D. | Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它极易溶于水,是因为它与水分子间容易形成氢键,它与W元素的氢化物反应形成的化合物属于离子晶体;
,它极易溶于水,是因为它与水分子间容易形成氢键,它与W元素的氢化物反应形成的化合物属于离子晶体;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com