
| 126g×2 |
| 32g |
| 25.2g |
| 252g/mol |
| 12.6g |
| 18g/mol |
| ||
| ||


科目:高中化学 来源: 题型:
| A、2NaBr+Cl2=2NaCl+Br2 |
| B、AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl |
| C、2H2S+SO2=2H2O+3S↓ |
| D、2FeCl3+H2S=2FeCl2+S↓+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、Ag2S沉淀溶解平衡表达式:Ag2S?2Ag++S2- |
| C、氢硫酸与硫酸铜反应:S2-+Cu2+=CuS↓ |
| D、NaHCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:| 压强/Mpa NH3含量/% 温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
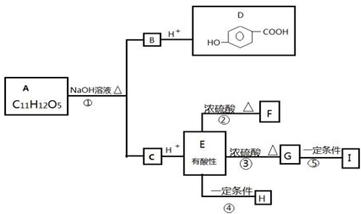
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol/L的Na2HPO4溶液中存在如下的平衡;HPO42-?H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小 |
| B、饱和NH4Cl中:c(H+)+c(Cl-)=c(NH4+)+2c(NH3?H2O)+c(OH-) |
| C、常温下,0.1mol/L的HA和BOH两种溶液,其pH值分别为3和12,将两溶液等体积混合后,所得溶液的pH≤7 |
| D、在NH4HSO3与NH4Cl混合溶液中:c(NH4+)=c(SO32-)+c(HSO3-)+c(H2SO3)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com