
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 1 mol·L-1的K2SO4溶液中含有2 mol K+
B. 1 mol Cl2完全溶于水转移电子数为NA
C. 标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为4NA
D. 20 g T2O中含有NA个氧原子
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】下列说法或做法正确的是
A.液氯是混合物,氯水是纯净物
B.金属钠着火燃烧时,用泡沫灭火器灭火
C.铝比铁活泼,所以铝比铁更容易被腐蚀
D.CO2通入可溶性硅酸盐中析出硅酸胶体,所以硅酸的酸性小于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应其△H=-122 kJ/mol,S=231 J/(mol·K),则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行B.在任何温度下都不能自发进行
C.仅在高温下自发进行D.仅在低温下自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
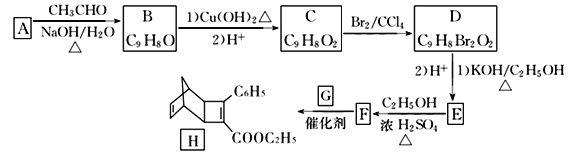
已知:①RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题:
(1)A的化学名称是____________,D中含有的官能团名称为_______________________。
(2)由F生成H的反应类型是_______________。
(3)G为甲苯的同分异构体,G的结构简式为_________________。
(4)由D生成E第(1)步的化学方程式为:____________________________________________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液放出CO2, 其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。符合要求的X有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了图中的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置略去)。
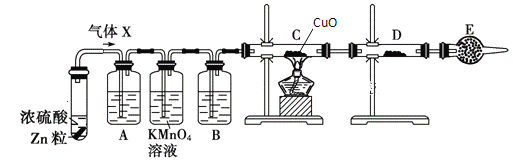
试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为_______
(2)A中加入的试剂可能是_____,作用是_____;B中加入的试剂可能是_____,作用是_____;E中加入的试剂可能是_____,作用是_____
(3)可以证明气体X中含有氢气的实验现象:C中______,D中____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效消毒剂,可用如下反应制得:2NaClO3+Na2SO3+H2SO4![]() 2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
A. 该反应属于复分解反应
B. NaClO3被还原,发生还原反应
C. 反应中Na2SO3作氧化剂
D. 生成6.75 g ClO2时,转移0.2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,能达到实验目的的是
A.  验证酸性HCl > H2SiO3
验证酸性HCl > H2SiO3
B. 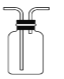 收集 HCl或 CO
收集 HCl或 CO
C. 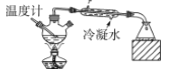 分离沸点不同且互溶的液体混合物
分离沸点不同且互溶的液体混合物
D. ![]() 分离酒精和水
分离酒精和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去)。

(1)验证碳、硅非金属性的相对强弱(已知酸性:亚硫酸>碳酸)。
①连接仪器、________________、加药品后,打开a、关闭b,然后滴入浓硫酸,加热。②铜与浓硫酸反应的化学方程式是________________,装置A中试剂是_______。③能说明碳的非金属性比硅强的实验现象是_______________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是____________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应的位置______。

写出其中SO2显示还原性生成沉淀的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一氧化碳与水蒸气的反应为:CO(g)+H2O (g)![]() CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
(1)氢气作为燃料与汽油相比,其优点是____________________________________________(答一条即可)。
(2)800℃时,在容积为2.0L的密闭容器中充入2.0mlCO(g)和3.0molH2O(g),保持温度不变,4min后
反应达到平衡,测得CO的转化率为60%。
①4min内H2的平均化学反应速率为__________mol/(L·min)。
②800℃时该反应的平衡常数值为__________。请结合题中的信息判断该反应的△H__________0。
(3)一定条件下,设起始加入二氧化碳和氢气且![]() = Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)
= Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)

A.该反应的焓变△H>0
B.图中Z的大小为b>3>a
C.图中x 点对应的平衡混合物中![]() = 3
= 3
D.温度不变时,图中x点对应的平衡在加压后φ(CO2)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com