
| A.A为固体,C为气体,正反应为放热反应 |
| B.A、C均为气体,正反应为吸热反应 |
| C.A为气体,C为固体,正反应为吸热反应 |
| D.A为气体,C为固体,正反应为放热反应 |
科目:高中化学 来源:不详 题型:单选题
| A.电解水时,加少量硫酸可使电解速率加快 |
| B.H2O2中加入少量MnO2,即可迅速放出气体 |
| C.在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 |
| D.用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.NaOH固体 | B.醋酸钠固体 | C.AgNO3溶液 | D.H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤ | B.②④⑥ | C.①④⑥ | D.②③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应速率只能用反应物浓度的减少量表示 |
| B.只有温度和催化剂才能影响化学反应速率 |
| C.化学平衡状态指的是反应物和生成物浓度相等时的状态 |
| D.催化剂既能改变正反应的反应速率,又能改变逆反应的反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2(g)的消耗速率与HI(g)的生成速率之比为2:1 |
| B.反应进行的净速率是正、逆反应速率之差 |
| C.正、逆反应速率的比值是恒定的 |
| D.达到平衡时,给体系加压,正、逆反应速度都不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)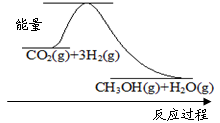
 CH3OH(g)+H2O(g)已达到平衡的是 (单选)。
CH3OH(g)+H2O(g)已达到平衡的是 (单选)。| A.恒温、恒容条件下,容器内的压强不发生变化 |
| B.一定条件下,CH3OH消耗的速率和CH3OH生成的速率相等 |
| C.一定条件下,H2O(g)的浓度保持不变 |
| D.一定条件下,单位时间内消耗1 mol CO2,同时生成1 mol CH3OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com