
| ||
| A、该反应的氧化剂只有Cu2O |
| B、还原产物与氧化产物的物质的量之比为1:6 |
| C、Cu2S在反应中既是氧化剂,又是还原剂 |
| D、Cu既是氧化产物又是还原产物 |
| ||


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| 焙烧 |
| 焙烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝和氯化铁在水中都能形成胶体,都可用作净水剂 |
| B、金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
| C、浓HNO3有强氧化性,常温下能与Fe发生剧烈反应 |
| D、将SO2通入溴水,溴水褪色后加热能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体体积的大小只随分子数的多少变化 |
| B、相同体积的气体含有相同的分子数 |
| C、不同气体分子的大小几乎相等 |
| D、不同气体分子间的平均距离几乎相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol乙烷分子中含有8NA个共价键 |
| B、0.05mol熔融的KHSO4中含有阳离子的数目为0.05 NA |
| C、标准状况下,22.4L甲醇的分子数为NA |
| D、1mol/L的氯化铵溶液含氮原子数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
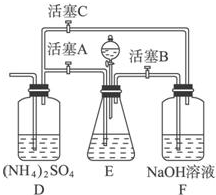 摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂.某研究性学习小组设计了下面的实验装置来制备摩尔盐.
摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂.某研究性学习小组设计了下面的实验装置来制备摩尔盐.查看答案和解析>>
科目:高中化学 来源: 题型:
 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com