
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: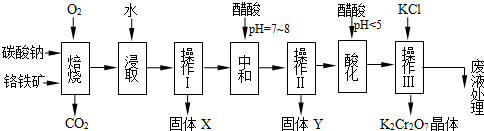
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2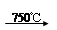 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3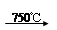 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
 ), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。
), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。(16分)(1)Fe2O3、MgO(2分,有错即为0分,少一个扣1分);pH计或精密pH试纸。(1分,
答pH试纸或广泛pH试纸不给分)
(2)使CrO42-转化为Cr2O72-。(1分) (3)冷却结晶、洗涤。(各1分)
(4)K2Cr2O7的溶解度比Na2Cr2O7小(1分)(或四种物质中K2Cr2O7的溶解度最小)。
(5)Cr2O72- + 4H2O2 +2H+= 2CrO5 + 5H2O (2分) 不属于(1分)
(6)①溶液蓝色恰好褪色为滴定终点(2分)
②94.1%(4分,在±0.1%范围内不扣分,有效数字错扣2分)
解析试题分析:(1)铬铁矿的主要成分可表示为FeO?Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,因此加入氧气和碳酸钠发生反应为①4FeO?Cr2O3+8Na2CO3+7O2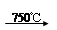 8Na2CrO4+2Fe2O3+8CO2↑、②Na2CO3+Al2O3
8Na2CrO4+2Fe2O3+8CO2↑、②Na2CO3+Al2O3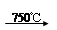 2NaAlO2+CO2↑、③Cr2O72-+H2O
2NaAlO2+CO2↑、③Cr2O72-+H2O 2CrO42-+2H+。氧化铁、氧化铝不溶于水,操作Ⅰ是过滤,因此得到固体X为Fe2O3、MgO。要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸。
2CrO42-+2H+。氧化铁、氧化铝不溶于水,操作Ⅰ是过滤,因此得到固体X为Fe2O3、MgO。要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸。
(2)酸化步骤用醋酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知,结合反应平衡Cr2O72-+H2O 2CrO42-+2H+可知,加入酸,溶液中氢离子浓度增大,平衡左移,所以目的是使CrO42-转化为Cr2O72-。
2CrO42-+2H+可知,加入酸,溶液中氢离子浓度增大,平衡左移,所以目的是使CrO42-转化为Cr2O72-。
(3)对于易溶性物质,从溶液得到晶体的操作一般是蒸发浓缩、冷却结晶、过滤,将得到的晶体洗涤干燥即可。因此要获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体。
(4)依据表中物质的溶解度数据分析对比,依据操作Ⅲ发生反应的化学方程式Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl可知,该反应之所以能发生是因为K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小)。
(5)酸性溶液中过氧化氢能使Cr2O72-生成蓝色的过氧化铬,由于溶液显酸性,因此反应物还有氢离子参加,根据原子守恒可知,生成物还有水生成,因此反应的离子方程式为Cr2O72- + 4H2O2 +2H+=2CrO5 + 5H2O。根据CrO5分子结构 可知,该化合物中Cr元素的化合价仍然是+6价,其中氧元素的化合价有4个-1价的,1个-2价的,因此该反应前后元素的化合价均没有发生变化,所以反应不是氧化还原反应。
可知,该化合物中Cr元素的化合价仍然是+6价,其中氧元素的化合价有4个-1价的,1个-2价的,因此该反应前后元素的化合价均没有发生变化,所以反应不是氧化还原反应。
(6)①由于碘单质遇淀粉显蓝色,所以根据反应I2+2S2O32—=2I-+S4O62—可知,判断达到滴定终点的依据是溶液蓝色恰好褪色且半分钟不恢复即为滴定终点。
②根据反应Cr2O72-+6I-+14H+=2Cr3++3I2+ 7H2O、I2+2S2O32—=2I-+S4O62—可知
Cr2O72-~~~3I2~~~6S2O32—
1mol 6mol
n(K2Cr2O7) 0.1200mol/L×0.04L
即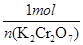 =
=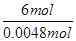
解得n(K2Cr2O7)=0.0008mol
所以2.500g重铬酸钾试样中重铬酸钾的物质的量=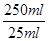 ×0.0008mol=0.008mol
×0.0008mol=0.008mol
质量=0.008mol×294g/mol=2.352g
因此所得产品中重铬酸钾的纯度为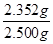 ×100%=94.1%
×100%=94.1%
考点:考查工艺流程题的应用、物质的分离与提纯、氧化还原反应的判断、物质含量测定


科目:高中化学 来源: 题型:填空题
过硫酸钾( )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液。写出电解时发生反应的离子方程式_____________________________________
___________________________________。
(2)已知相关物质的溶解度曲线如右图所示。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,________________,干燥。
(3)样品中过硫酸钾的含量可用碘量法进行测定。实验步骤如下:
步骤1:称取过硫酸钾样品0.300 0 g于碘量瓶中,加入30 mL水溶解。
步骤2:向溶液中加入4.00 0 g KI固体(略过量),摇匀,在暗处放置30 min。
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00 mL。
(已知反应:I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将碘量瓶“在暗处放置30 min”,立即进行步骤3,则测定的结果可能________(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是____________________________________________。
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为_______________。
③为确保实验结果的准确性,你认为还需要____________________________。
(4)将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图所示(H+浓度未画出)。图中物质X的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用霞石岩(化学式为 KNa3[AlSiO4]4,主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:
已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度见右图。
试回答下列问题:
(1)灼烧得到固体M的化学方程式是________________________________。
(2)X物质是___________,滤液W中主要含有的离子有____________。(写三种)
(3)操作Ⅰ得到碳酸钠晶体的操作为 、 、 、洗涤、干燥。
(4)碳酸化Ⅰ中发生主要反应的离子方程式是__________________________。
(5)碳酸化Ⅱ调整pH=8的目的是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下: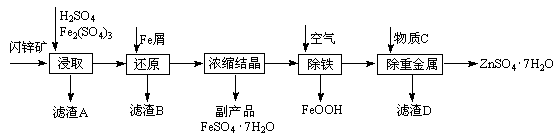
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
溴化钙(CaBr2·2H2O)是一种白色晶体,易溶于水,有很强的吸湿性,是光敏纸矿泉水和灭火剂的重要成分,在医药上用作治疗神经衰弱等的药物,也用作化学分析。用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下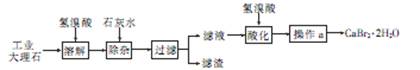
回答下列问题
(1)溶解时发生的主要反应的离子方程式为
(2)除杂步骤控制溶液的pH约为8.0的目的是 ,
(3)滤液用氢溴酸酸化的目的是 ,操作a主要包括 , 和过滤
(4)制得的溴化钙晶体可以通过如下步骤测定其纯度:
①称取5.00g溴化钙晶体样品,②溶解;③滴入足量Naa2CO3溶液,充分反应后过滤,④烘干、冷却;⑤称量。若得到2. 00 g碳酸钙,则样品的纯度为
(5)溴化钙晶体中溴离子和钙离子的检验
①将少量溴化钙晶体溶于水,加入硝酸酸化的AgNO3溶液,实验现象为 ,发生反应的离子方程式为
②将少量溴化钙晶体溶于水,滴加草酸钠溶液,实验现象为 ,发生反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿(主要成份:CuO ZnO)的方案,实现废物综合利用,方案如下图所示。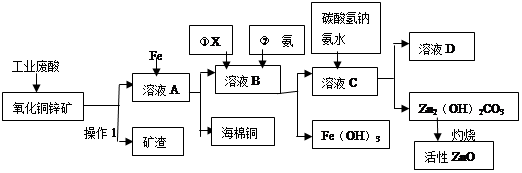
请回答下列问题:
(1)操作1的名称是:
(2)向溶液A中加入Fe粉发生的主要的反应离子方程式为: 、 。
(3)向溶液B中加入物质X的目的是 ,物质X可用下列物质中的 。(填字母)
| A.KMnO4 | B.O2 | C.H2O2 | D.NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下: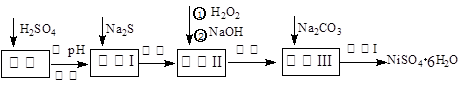
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式__________ __________
(2) 加6%的H2O2时,温度不能过高,是因为: _____ ________ 。
(3) 除铁方法:用H2O2充分氧化后,再用NaOH控制pH值3~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为:___________________________________________________________________________
(4)上述流程中滤液Ⅲ的主要成分是: 。(填化学式)
(5)操作Ⅰ包括以下过程:过滤,用 (填试剂化学式)溶解, ,洗涤获得产品。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:
(1)该混合物中一定含有 ;一定不含有 ,可能含有 。
(2)如要对可能含有的物质进行检验,如何操作:
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气,最终制得硫酸锰晶体(MnSO4·H2O),其主要流程如下: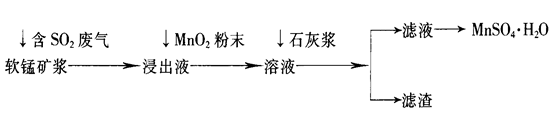
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com