
| A. | 一定都是由质子、中子、电子组成的 | |
| B. | 化学性质几乎完全相同 | |
| C. | 核电荷数和核外电子数一定相等 | |
| D. | 质子数一定相同,质量数和中子数一定不相同 |
分析 A.氕原子不含有中子;
B.ZAX为原子,ZA+1X+为离子,两者化学性质不相同;
C.ZAX的核电荷数为Z,核外电子数为Z;ZA+1X+的核电荷数为Z,核外电子数为z-1;
D.ZAX的质量数为A,中子数为A-Z;ZA+1X+的质量数为A+1,中子数为A+1-Z.
解答 解:A.氕原子不含有中子,故A错误;
B.ZAX为原子,ZA+1X+为离子,两者化学性质不相同,故B错误;
C.ZAX的核电荷数为Z,核外电子数为Z;ZA+1X+的核电荷数为Z,核外电子数为z-1,故核电荷数相同,核外电子数不同,故C错误;
D.ZAX的质量数为A,中子数为A-Z;ZA+1X+的质量数为A+1,中子数为A+1-Z,故质子数相同,质量数和中子数不同,故D正确,
故选D.
点评 本题考查核素的构成和性质,难度不大,要注意氕原子不含有中子,核电荷数=质子数=质量数-中子数.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | c(H2)保持不变 | |
| B. | 拆开2 mol H-I共价键,同时生成1 mol H-H共价键 | |
| C. | HI、H2、I2的浓度比为2:1:1 | |
| D. | 正反应和逆应都已停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(D)=0.40 mol•L-1•s-1 | B. | υ(C)=0.50 mol•L-1•s-1 | ||
| C. | υ(A)=0.30 mol•L-1•s-1 | D. | υ(B)=0.60 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| B. | 元素X与W形成的共价化合物有很多种 | |
| C. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 提高高锰酸钾的氧化能力,用盐酸酸化 | |
| B. | 抑制Fe2+的水解,用稀硝酸酸化 | |
| C. | 检验某氯代烷烃中含氯元素,加碱溶液加热后用稀硝酸酸化,再加硝酸银溶液检验 | |
| D. | 确认某溶液中含有SO42-时,先加入盐酸酸化,再加氯化钡溶液检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

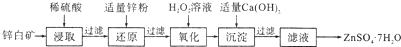
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 乙烯酮在一定条件下能与含活泼氢的化合物发生加成:它与下列试剂发生加成反应时所生成的产物不正确的是( )
乙烯酮在一定条件下能与含活泼氢的化合物发生加成:它与下列试剂发生加成反应时所生成的产物不正确的是( )| A. | 与HCl加成生成CH3COCl | B. | 与H2O加成生成CH3COOH | ||
| C. | 与CH3OH加成生成CH3COCH2OH | D. | 与CH3COOH加成生成(CH3CO)2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com