
| A、28.6% |
| B、42.6% |
| C、41.2% |
| D、57.4% |
| m |
| M |
| Wg |
| 197g/mol |
| W |
| 197 |
| W |
| 197 |
| W |
| 197 |
| 84 |
| 197 |
| 84 |
| 197 |
| 113 |
| 197 |
| ||
| Wg |


科目:高中化学 来源: 题型:
A、离子结构示意图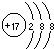 只能表示 只能表示
| ||
B、水的球棍模型: | ||
| C、碳酸氢钠在水溶液中的电离方程式:NaHCO3=Na++HCO3- | ||
D、作为相对原子质量标准的碳原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中Ca2+的浓度增大 |
| B、溶液中Ca2+的浓度减小 |
| C、溶液中pH不变 |
| D、溶液中pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
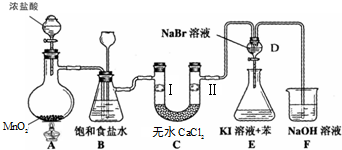
查看答案和解析>>
科目:高中化学 来源: 题型:
A、稀释Na2CO3溶液时,
| ||||||
B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
| ||||||
| C、相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | ||||||
| D、常温下反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H<0,△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、一氯丙烷与NaOH乙醇溶液共热:CH3CH2CH2Cl+NaOH
| |||
B、乙醇与浓硫酸共热到140℃:C2H5OH
| |||
C、将灼热的铜丝伸入盛有无水乙醇的试管中:2CH3CH2OH+O2
| |||
D、向苯酚钠中通入少量CO2: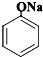 +CO2+H2O→ +CO2+H2O→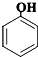 +NaHCO3 碳酸的酸性比苯酚强 +NaHCO3 碳酸的酸性比苯酚强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com