
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由于石墨转化为金刚石是吸热反应,所以金刚石比石墨稳定 | |
| C. | 在稀溶液中,强酸与强碱反应生成1molH2O将吸收57.3kJ热量 | |
| D. | 在101kPa时,2g氢气完全燃烧生成液态水放出285.8kJ热量,则等质量的氢气完全燃烧生成气态水时放出热量将小于285.8kJ |
分析 A.等质量的硫蒸气具有的能量比硫固体多;
B.能量越大的物质越不稳定;
C.中和热为放热反应;
D.水蒸气变化为液态水放出热量.
解答 解:A.等质量的硫蒸气和硫固体相比较,硫蒸气具有的能量多,因此完全燃烧硫蒸气放出的热量多,故A错误;
B.C(石墨)═C(金刚石)为吸热反应,则石墨能量小于金刚石,所以石墨比金刚石稳定,故B错误;
C.在稀溶液中,强酸和强碱反应生成1molH2O(1),将放出57.3kJ热量,故C错误;
D.水蒸气变化为液态水放出热量,等质量的氢气完全燃烧分别生成液态、气态水,前者放出热量多,故D正确;故选D.
点评 本题考查了反应的能量变化,要求学生掌握吸热反应和放热反应的相关知识,掌握基础是关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①② | C. | ③⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
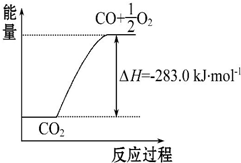 已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1| A. | 通常状况下,氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 由①可知,1 mol CO(g)和$\frac{1}{2}$mol O2(g)反应生成1 mol CO2(g),放出283.0 kJ的热量 | |
| C. | 可用右图表示2CO2(g)═2CO(g)+O2(g)反应过程中的能量变化关系 | |
| D. | 分解1 mol H2O(g),其反应热为-241.8 KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将H2SO4溶液改为浓硫酸 | |
| B. | 用1mol/LH2SO4溶液代替原H2SO4溶液 | |
| C. | 用锌粉代替块状锌 | |
| D. | 用同浓度热的H2SO4溶液代替原H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HCl不能导电,所以HCl是非电解质 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 在水溶液中能电离产生H+的化合物不一定是酸 | |
| D. | 盐、碱一定含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 海洋是一座巨大的宝藏,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.而以海水为主要原料的海洋化学工业,又被称为“蓝色化工”.
海洋是一座巨大的宝藏,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.而以海水为主要原料的海洋化学工业,又被称为“蓝色化工”.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com