
某研究性学习小组用FeCl3溶液做“腐蚀液”,制作印刷电路板,其反应原理是:2FeCl3+Cu=2FeCl2+CuCl2。
【实验探究】
(1)通过《化学1》的学习,知道了有离子参加的化学反应为离子反应。离子反应可用离子方程式表示。请写出2FeCl3+Cu=2FeCl2+CuCl2反应的离子方程式为: 。
(2)若要溶解电路板上3.2g的铜,则至少需要FeCl3物质的量为 mol。
(3)使用后失效的“腐蚀液”为废液,验证废液中是否存在Fe3+的试剂是 ,加入该试剂后,若出现 现象,说明废液中还存在Fe3+。
(4)废液中的CuCl2可通过加入足量的 ,反应后转化成铜且能使所得溶液中含有单一溶质。
(5)回收Cu后的废液,通入足量的Cl2,可以重新获得FeCl3溶液,其反应的化学方程式为 。
【实验结论】
利用FeCl3溶液做印刷电路板的“腐蚀液”,不仅废液中的铜可以得到回收,经过处理后的废液还可以重新使用。
【知识拓展】
(6)铁元素是维持生命活动不可缺少的微量元素,虽然人体中通常只含有3~5g铁元素,但铁元素在人体中却发挥着重要作用,人体缺铁会引起 疾病。
(13分)(1) 2Fe3+ + Cu=2Fe2+ + Cu2+ [2分] (2)0.1 [2分]
(3)KSCN溶液(或NaOH溶液), 溶液呈(血)红色(或红褐色沉淀) [每空2分(其它合理答案均得分)]
(4)铁粉 [2分] (5)2FeCl2+Cl2=2FeCl3 [2分] (6)贫血 [1分]
【解析】
试题分析:(1)根据化学方程式可知,该反应的离子方程式是2Fe3+ + Cu=2Fe2+ + Cu2+。
(2)3.2g铜的物质的量是3.2g÷64g/mol=0.05mol,则根据反应的化学方程式可知,至少需要FeCl3物质的量为0.05mol×2=0.1mol。
(3)检验铁离子的方法是KSCN溶液或氢氧化钠溶液,实验现象是溶液呈(血)红色(或红褐色沉淀)。
(4)铁的金属性强于铜的,所以废液中的CuCl2可通过加入足量的铁粉,反应后转化成铜且能使所得溶液中含有单一溶质。
(5)氯气具有氧化性,能把氯化亚铁氧化,反应的离子方程式是2FeCl2+Cl2=2FeCl3。
(6)人体缺铁会引起贫血疾病。
考点:考查离子方程式的书写、氧化还原反应的计算、铁离子的检验、金属的回收以及铁元素对人体健康的关系
点评:该题是高考中的常见题型和考点,属于基础性试题的考查,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。也有利于调动学生的学习兴趣和学习积极性,提高学生灵活运用基础知识解决实际问题的能力。


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源: 题型:
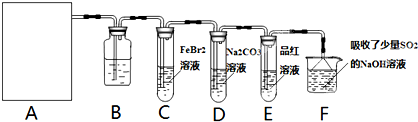
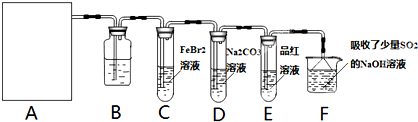
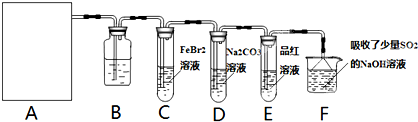
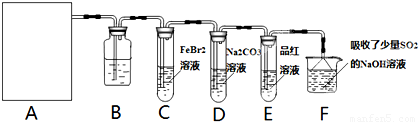
莫尔盐[(NH4)2SO4?FeSO4?6H2O]空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用下图所示的实验装置来制取莫尔盐,实验步骤如下:

① 用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离,将分离出的NaOH溶液装入F中;
② ②在E中用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③ 将②制得的FeSO4溶液与(NH4)2SO4溶液混合,结晶得到莫尔盐。
试回答下列问题:
(1)利用铁屑和稀硫酸反应产生的氢气赶走装置中的氧气及硫酸铵溶液中溶解的氧,其目的是 ;铁屑和稀硫酸反应产生的氢气的另外一个作用是 。
(2)如何设计一个简单的实验证明得到的产品中有Fe2+?
。
(3)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。若取产品24.50g配成100mL溶液,取出10mL用0.10mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL。
①(2分)试配平反应的离子方程式:
MnO-4+ Fe2++ H+ == Fe3++ Mn2+ + H2O
②(4分)求产品中莫尔盐的质量分数 。(莫尔盐的相对分子质量为392)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省泸州市高级教育培训学校高三(上)月考化学试卷(10月份)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com