
| A. | NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=8的NaB溶液中:c(Na+)>c(B-)>c(OH-)>c(H+) | |
| C. | 物质的量浓度相等的①CH3COONH4、②NH4Cl、③NH4HSO4三种溶液中:c(NH4+)大小顺序①=②>③ | |
| D. | 常温下.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL(反应后溶液的总体积为两反应液体积之和) |
分析 A.碳酸氢钠溶液中存在物料守恒,n(Na)=n(C);
B.pH=8的NaB溶液显碱性,B-离子水解;
C.弱电解质部分电离,强电解质完全电离,弱碱阳离子在溶液中发生水解,氢离子抑制阳离子的水解,双水解程度较一般水解程度大;
D.如果HA是强酸,当溶液的pH=7,HA体积为10mL,如果HA是弱酸,当溶液的pH=7时,HA体积小于10mL.
解答 解:A.碳酸氢钠溶液中存在物料守恒,n(Na)=n(C),c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故A正确;
B.pH=8的NaB溶液显碱性,B-离子水解,溶液中离子浓度大小为:c(Na+)>c(B-)>c(OH-)>c(H+),故B正确;
C.相同温度、相同浓度的这三种盐溶液,氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解,铵根离子水解程度越大,则溶液中铵根离子浓度越小,所以溶液中铵根离子浓度大小顺序是③>②>①,故C错误;
D.如果HA是强酸,当溶液的pH=7,HA体积为10mL,如果HA是弱酸,当溶液的pH=7时,HA体积小于10mL,所以所得溶液的总体积V≤20ml,故D错误;
故选CD.
点评 本题考查了酸碱混合溶液定性判断,盐类水解原理的分析判断,明确溶液中的溶质、溶液酸碱性再结合守恒思想分析解答,注意溶液中物料守恒的应用,题目难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 向煮沸的1 mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| B. | 乙烯能被高锰酸钾氧化,利用此反应可鉴别乙烷和乙烯 | |
| C. | 实验室通常用加热分解NH4Cl固体的方法制取氨气 | |
| D. | 直接观察某盐溶液的焰色反应为黄色,则该溶液中一定不含钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的熔、沸点比第ⅤA族其他元素氢化物的熔、沸点高 | |
| B. | 乙酸可以和水以任意比互溶 | |
| C. | 常温下H2O为液态,而H2S为气态 | |
| D. | 水分子高温下也很稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Mg2+、SO42-、OH- | B. | Fe2+、NO3-、Cl-、H+ | ||
| C. | H+、Cl-、K+、HSO3- | D. | Na+、HCO3-、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
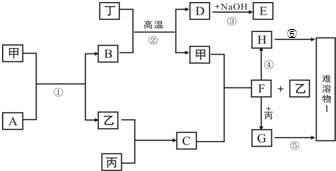
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸与铁屑反应的离子方程式:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠与CuSO4溶液反应的离子方程式:2Na+Cu2+═Cu↓+2Na+ | |
| C. | NaHCO3溶液与NaOH反应的离子方程式:HCO3-+OH-═H2O+CO2↑ | |
| D. | 将CO2通入饱和碳酸钠溶液直至过量的离子方程式:2Na++CO2+CO32-+H2O═2NaHCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
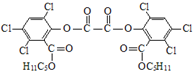 “魔棒”常用于晚会气氛的渲染,其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后发光.草酸二酯(CPPO)结构简式如下图所示,请回答下列问题:
“魔棒”常用于晚会气氛的渲染,其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后发光.草酸二酯(CPPO)结构简式如下图所示,请回答下列问题: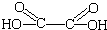 ).
).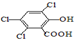 )在催化剂和适当条件下可以生成CPPO,
)在催化剂和适当条件下可以生成CPPO,| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(S) | ||
| C(mo•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
 .类似的
.类似的 ,也可以发生反应生成N,则N结构简式为
,也可以发生反应生成N,则N结构简式为 (写出其中的一种).
(写出其中的一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的溶液导电能力强于弱电解质的溶液 | |
| B. | CO2的水溶液可以导电,所以CO2是电解质 | |
| C. | 所有盐均电离出金属阳离子和酸根离子 | |
| D. | 电离时生成的阳离子全部是氢离子的化合物叫做酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com