
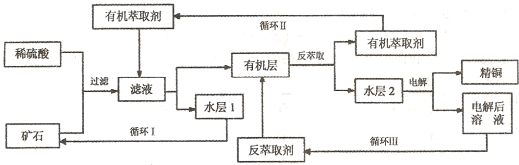
ijĶæóŹÆŗ¬Ńõ»ÆĶ”¢Ńõ»ÆŃĒĶ”¢ČżŃõ»Æ¶žĢśŗĶĀöŹÆ£ØSiO2) £¬ĻÖ²ÉÓĆĖį½ž·Ø“ÓæóŹÆÖŠĢįČ”Ķ£¬Ę乤ŅÕĮ÷³ĢĶ¼ČēĻĀ”£ĘäÖŠĶµÄŻĶČ”£ØĶ“ÓĖ®²ć½ųČĖÓŠ»ś²ćµÄ¹ż³Ģ£©ŗĶ·“ŻĶČ”£ØĶ“ÓÓŠ»ś²ć½ųČĖĖ®²ćµÄ¹ż³Ģ£©ŹĒĻÖ“śŹŖ·ØĮ¶ĶµÄÖŲŅŖ¹¤ŅÕŹÖ¶Ī”£
ŅŃÖŖ£ŗ¢ŁCu2O+2H+£½Cu2++Cu + H2O£»¢Śµ±æóŹÆÖŠČżŃõ»Æ¶žĢśŗ¬ĮæĢ«µĶŹ±£¬æÉÓĆĮņĖįŗĶĮņĖįĢśµÄ»ģŗĻŅŗ½ž³öĶ£» ¢Ū·“ŻĶČ”ŗóµÄĖ®²ć2ŹĒĮņĖįĶČÜŅŗ”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)æóŹÆÓĆĻ”ĮņĖį“¦Ąķ¹ż³ĢÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCu2O+2H+£½Cu2++Cu + H2O
”¢ £ØŠ“ĘäÖŠ2øö£©
(2)½«ÓŠ»ś²ćŗĶĖ®²ć·ÖĄėµÄ²Ł×÷·½·Ø½Š £¬ŹµŃéŹ½Ķź³É“Ė²Ł×÷ĖłÓƵ½µÄŅ»ÖÖÖ÷ŅŖŅĒĘ÷ŹĒ ”£
(3)”°Ń»·I”±¾¶ą“ĪŃ»·ŗóµÄĖ®²ć1²»ÄܼĢŠųŃ»·Ź¹ÓĆ£¬µ«æÉ·ÖĄė³öŅ»ÖÖÖŲŅŖµÄĮņĖįŃĪ¾§Ģ壬øĆ¾§ĢåµÄ»ÆѧŹ½ŹĒ ”£
(4)Š“³öµē½ā¹ż³ĢÖŠ£ØĮ½µē¼«¶¼ŹĒ¶čŠŌµē¼«£©Ņõ¼«·¢Éś·“Ó¦µÄµē¼«·“Ó¦Ź½
(5)”°Ń»·¢ó”±ÖŠ·“ŻĶČ”¼ĮµÄÖ÷ŅŖ³É·ÖŹĒ
 ĆæČÕ10·ÖÖÓæŚĖćŠÄĖćĖŁĖćĢģĢģĮ·ĻµĮŠ“š°ø
ĆæČÕ10·ÖÖÓæŚĖćŠÄĖćĖŁĖćĢģĢģĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
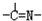 ČżÖÖ»łĶÅ£¬ĪŽ»·×“½į¹¹£¬ČżÖÖ»łĶÅµÄŹżÄæ¹ŲĻµĪŖn3=
ČżÖÖ»łĶÅ£¬ĪŽ»·×“½į¹¹£¬ČżÖÖ»łĶÅµÄŹżÄæ¹ŲĻµĪŖn3=

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

 ČżÖÖ»łĶÅ£¬ĪŽ»·×“½į¹¹£¬ČżÖÖ»łĶÅµÄŹżÄæ¹ŲĻµĪŖn3=
ČżÖÖ»łĶÅ£¬ĪŽ»·×“½į¹¹£¬ČżÖÖ»łĶÅµÄŹżÄæ¹ŲĻµĪŖn3=²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā

 ČżÖÖ»łĶÅ£¬ĪŽ»·×“½į¹¹£¬ČżÖÖ»łĶÅµÄŹżÄæ¹ŲĻµĪŖn3=
ČżÖÖ»łĶÅ£¬ĪŽ»·×“½į¹¹£¬ČżÖÖ»łĶÅµÄŹżÄæ¹ŲĻµĪŖn3=²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011½ģ¹ć¶«Ź”ÉīŪŚøß¼¶ÖŠŃ§øßČżøßæ¼Ē°×īŗóÄ£ÄāŹŌ¾ķ£ØĄķ×Ū£©»Æѧ²æ·Ö ĢāŠĶ£ŗŹµŃéĢā
ijĶæóŹÆŗ¬Ńõ»ÆĶ”¢Ńõ»ÆŃĒĶ”¢ČżŃõ»Æ¶žĢśŗĶĀöŹÆ£ØSiO2) £¬ĻÖ²ÉÓĆĖį½ž·Ø“ÓæóŹÆÖŠĢįČ”Ķ£¬Ę乤ŅÕĮ÷³ĢĶ¼ČēĻĀ”£ĘäÖŠĶµÄŻĶČ”£ØĶ“ÓĖ®²ć½ųČĖÓŠ»ś²ćµÄ¹ż³Ģ£©ŗĶ·“ŻĶČ”£ØĶ“ÓÓŠ»ś²ć½ųČĖĖ®²ćµÄ¹ż³Ģ£©ŹĒĻÖ“śŹŖ·ØĮ¶ĶµÄÖŲŅŖ¹¤ŅÕŹÖ¶Ī”£
ŅŃÖŖ£ŗ¢ŁCu2O+2H+£½Cu2++Cu + H2O£»¢Śµ±æóŹÆÖŠČżŃõ»Æ¶žĢśŗ¬ĮæĢ«µĶŹ±£¬æÉÓĆĮņĖįŗĶĮņĖįĢśµÄ»ģŗĻŅŗ½ž³öĶ£» ¢Ū·“ŻĶČ”ŗóµÄĖ®²ć2ŹĒĮņĖįĶČÜŅŗ”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)æóŹÆÓĆĻ”ĮņĖį“¦Ąķ¹ż³ĢÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCu2O+2H+£½Cu2++Cu + H2O
”¢ £ØŠ“ĘäÖŠ2øö£©
(2)½«ÓŠ»ś²ćŗĶĖ®²ć·ÖĄėµÄ²Ł×÷·½·Ø½Š £¬ŹµŃéŹ½Ķź³É“Ė²Ł×÷ĖłÓƵ½µÄŅ»ÖÖÖ÷ŅŖŅĒĘ÷ŹĒ ”£
(3)”°Ń»·I”±¾¶ą“ĪŃ»·ŗóµÄĖ®²ć1²»ÄܼĢŠųŃ»·Ź¹ÓĆ£¬µ«æÉ·ÖĄė³öŅ»ÖÖÖŲŅŖµÄĮņĖįŃĪ¾§Ģ壬øĆ¾§ĢåµÄ»ÆѧŹ½ŹĒ ”£
(4)Š“³öµē½ā¹ż³ĢÖŠ£ØĮ½µē¼«¶¼ŹĒ¶čŠŌµē¼«£©Ņõ¼«·¢Éś·“Ó¦µÄµē¼«·“Ó¦Ź½
(5)”°Ń»·¢ó”±ÖŠ·“ŻĶČ”¼ĮµÄÖ÷ŅŖ³É·ÖŹĒ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com