
下列实验操作或结论表述正确的是( )
A.纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度快一些
B.判断CuO和MnO2对H2O2分解的催化效率,可通过比较H2O2溶液析出气泡的快慢程度,或测定单位时间内产生氧气的体积
C.食醋总酸含量测定实验中,实验结束时碱式滴定管尖嘴部位有气泡,则测定的醋酸含量偏高
D.将硫酸亚铁和硫酸铵的混合溶液加热浓缩,冷却结晶后可析出摩尔盐粗产品,再用酒精洗去晶体表面的水分,加热烘干后称重,计算产率
科目:高中化学 来源:2014-2015学年内蒙古呼伦贝尔市高三高考模拟考(一)理综化学试卷(解析版) 题型:选择题
莽草酸是合成达菲的主要原料,其结构简式如图,下列说法正确的是:
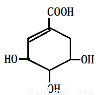
A.分子式为C7H8O5 B.能使溴的四氯化碳溶液褪色
C.只能发生加成反应和取代反应 D.分子中含有2种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作的叙述中,正确的是
A.向沸水中滴加过量饱和氯化铁溶液并不断搅拌,制取氢氧化铁胶体
B.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液一定含CO32-
C.向含Fe2+的溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色
D.用量筒取5.0mL10 mol·L-1H2SO4溶液于50mL容量瓶中,直接加水稀释至刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
用已准确称量过的氯化钠固体配制2.00mol·L-1的NaCl溶液0.2L,需要用到的仪器是:
①坩埚②分液漏斗③容量瓶④烧杯⑤胶头滴管⑥烧瓶⑦玻璃棒⑧托盘天平⑨药匙
A.③④⑤⑦⑨ B.①②⑤⑥⑧ C.③④⑤⑦ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中正确的是
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑的气体,证明该固体一定含有CO32-
C.取用Na2CO3溶液时,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
D.用浓硫酸配制一定物质的量浓度的稀硫酸时,将浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列原理或操作不正确的是
A.在如图装置的稀硫酸中加入适量重铬酸钾或适量6%的H2O2溶液,可以使灯泡亮度增大,持续时间变长
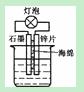
B.在提纯混有少量NaCl的KNO3时,常先将混合物在较高温度下溶于水形成浓溶液,再经过冷却结晶、过滤、洗涤、干燥,获得KNO3晶体
C.制摩尔盐时用酒精洗涤产品,用干净的滤纸吸干;而在制阿司匹林粗品时用冷水洗涤产品,在空气中风干
D.纸层析法分离微量成份时均需有以下流程:装置制作—→点层析试样—→配制展开剂—→层析操作—→显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O4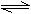 2NO2 △H > 0)
2NO2 △H > 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
A.(a)甲>乙(b)甲>乙 B.(a)甲>乙(b)甲=乙
C.(a)甲<乙(b)甲>乙 D.(a)甲>乙(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
(I)保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:
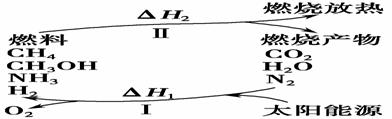
请回答下列问题:
(1)过程Ⅰ的能量转化形式为________能转化为________能。
(2)上述转化过程中,ΔH1和ΔH2的关系是________。
(3)断裂1 mol化学键所需的能量见下表:
| 共价键 | H—N | H—O | N≡N | O==O |
| 断裂1 mol化学键所需能量/(kJ·mol-1) | 393 | 460 | 941 | 499 |
常温下,N2与H2O反应生成NH3的热化学方程式为_______________________。
(II)在一试管中加入0.01mol/L的KMnO4酸性溶液和0.1mol/LH2C2O4溶液,在恒温下发生如下反应:
2 KMnO4+5 H2C2O4+3H2SO4===K2SO4+2Mn SO4+10CO2+8H2O;
 5分钟后测得Mn2+的浓度为0.004mol/L;
5分钟后测得Mn2+的浓度为0.004mol/L;
(4)试计算0—5分钟内,C(H2C2O4)=____________;
(5)如果反应从开始进行一段时间后,速率—时间图像如图:
试解释t1—t2,t2—t3速率变化的原因。
______________________________________________________________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com